Dati clinici della protesi vascolare GORE® PROPATEN®: Dati di sottogenicolare
Pervietà primaria del bypass sottogenicolare della protesi vascolare GORE® PROPATEN®
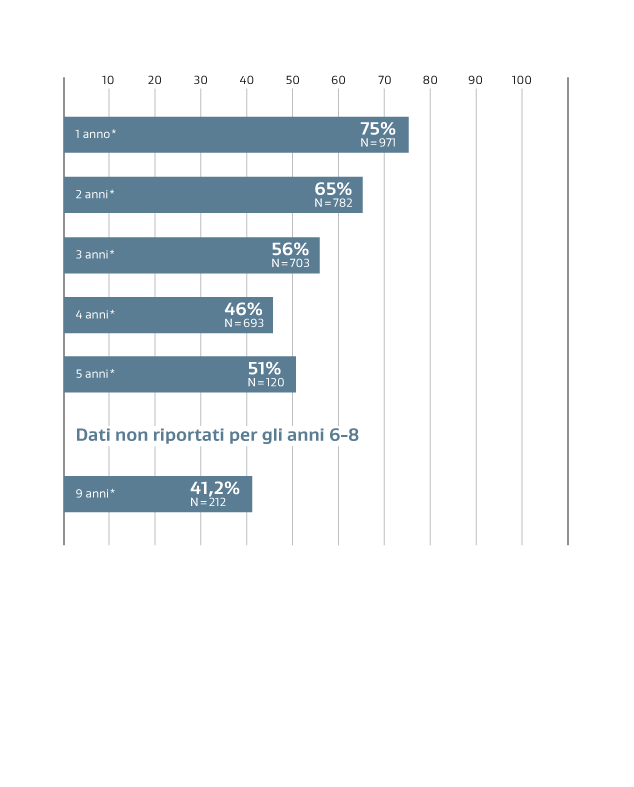
* La media ponderata complessiva della pervietà primaria è basata sui dati derivati da 10 pubblicazioni peer-reviewed che soddisfacevano predeterminati criteri di inclusione.
La dimensione dello studio (N) riflette la dimensione della coorte iniziale dello studio.
Dati di sottogenicolare | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Studio | Anno | Sede | N | Pervietà primaria | |||||
| Anno 1 | Anno 2 | Anno 3 | Anno 4 | Anno 5 | Anno 9 | ||||
| Kaisar et al | 2018 | Infrapoplitea | 62 | 85% | 71% | 64% | 57% | ||
| Uhl et al | 2015 | Infrapoplitea | 89 | 64% | 49% | 34% | |||
| Neville et al | 2014 | Infrapoplitea | 62 | 75% | |||||
| Monaca et al | 2013 | Infrapoplitea | 212 | 52% | 41% | ||||
| Dorigo et al | 2012 | Fem-pop BK Infrapoplitea | 414 142 | 45% 39% | |||||
| Pulli et al | 2010 | Fem-pop BK Infrapoplitea | 238 86 | 75% 66% | 67% 57% | 61% 52% | |||
| Daenens et al | 2009 | Fem-pop BK Infrapoplitea | 57 97 | 92% 79% | 83% 69% | ||||
| Hugl et al | 2009 | Fem-pop BK Infrapoplitea | 37 15 | 74% 79% | |||||
| Lösel-Sadée et al | 2009 | Fem-pop BK Infrapoplitea | 30 45 | 77% 64% | 71% 57% | 71% 50% | 71% 50% | 71% 50% | |
| Peeters et al | 2008 | Fem-pop BK Infrapoplitea | 41 37 | 86% 71% | 79% 60% | 75% 60% | |||
Criteri di inclusione
Criteri di inclusione per i dati della protesi vascolare GORE® PROPATEN® sottogenicolare, fem-pop e infrapoplitea utilizzati in questa analisi:
- Pubblicazioni di riviste cliniche peer-reviewed in lingua inglese
- Popolazioni di pazienti non sovrapposte
- Pervietà primaria del bypass BK segnalata per almeno 12 mesi di follow‑up
- N = 50 o più bypass BK (fem-pop BK e fem-distale BK) nel braccio di trattamento con protesi vascolare GORE® PROPATEN®

Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
INDICAZIONI PER L'USO IN EUROPA: la protesi vascolare GORE® PROPATEN® è indicata nei pazienti che necessitano di sostituzione o bypass dei vasi periferici a causa di malattie occlusive o aneurismatiche o trauma, oppure nei pazienti che necessitano di accesso arterovenoso per emodialisi negli arti superiori o inferiori a seguito di malattia renale in stadio terminale (ESRD).
La protesi vascolare GORE® PROPATEN® configurata per shunt pediatrico è indicata per il trattamento palliativo per "fasi" della cardiopatia congenita cianotizzante (CCHD).
CONTROINDICAZIONI: NON usare la protesi vascolare GORE® PROPATEN® in pazienti con ipersensibilità nota all'eparina, inclusi i pazienti che hanno presentato un'incidenza precedente di trombocitopenia indotta da eparina (HIT) di tipo II.
NON utilizzare alcuna delle configurazioni di protesi vascolari GORE® PROPATEN® elencate di seguito per interventi di bypass coronarico o di ricostruzione cerebrale:
- Protesi vascolare GORE® PROPATEN® con anelli integrati
- Protesi vascolare GORE® PROPATEN® con anelli fissi
- Protesi vascolare GORE® PROPATEN® con anelli rimovibili
- Protesi vascolare GORE® PROPATEN® axillo‑bifemorale con anelli rimovibili
NON utilizzare la protesi vascolare GORE® PROPATEN® come patch. Se tagliata e utilizzata come patch, la protesi vascolare GORE® PROPATEN® può non avere sufficiente resistenza trasversale.
PER LE APPLICAZIONI DI PATCH: per le procedure cardiovascolari che richiedono patch, utilizzare l'appropriato patch cardiovascolare GORE® ACUSEAL.