GORE® CARDIOFORM ASD Occluder – Klinische Daten
Gore ASSURED klinische Studie


Gore ASSURED klinische Studie: Ergebnisse nach 36 Monaten
Der GORE® CARDIOFORM ASD Occluder demonstriert nach wie vor sein bewährtes Sicherheitsprofil und seine hervorragende klinische Leistung, basierend auf mehr als 10 Jahren klinischer Anwendung. Hierbei wurden weltweit mehr als 15.000 Implantate für den perkutanen Verschluss von Ostium-Secundum-Vorhofseptum-Defekten (ASD) verkauft. ***,1
Ziel der Gore ASSURED klinischen Studie war die Bewertung der Sicherheit und Wirksamkeit des GORE® CARDIOFORM ASD Occluder.
Bewährte langfristige Leistung
100 % Verschlusserfolgsrate nach 36 Monaten bei Patienten mit technischem Erfolg*,†,1
Nachgewiesene Sicherheitsergebnisse
Konstante Sicherheitsergebnisse ‡ bei einem breiten Spektrum von ASD-Anatomien, darunter Patienten mit schmalen retroaortalen Rändern§,II,***,1
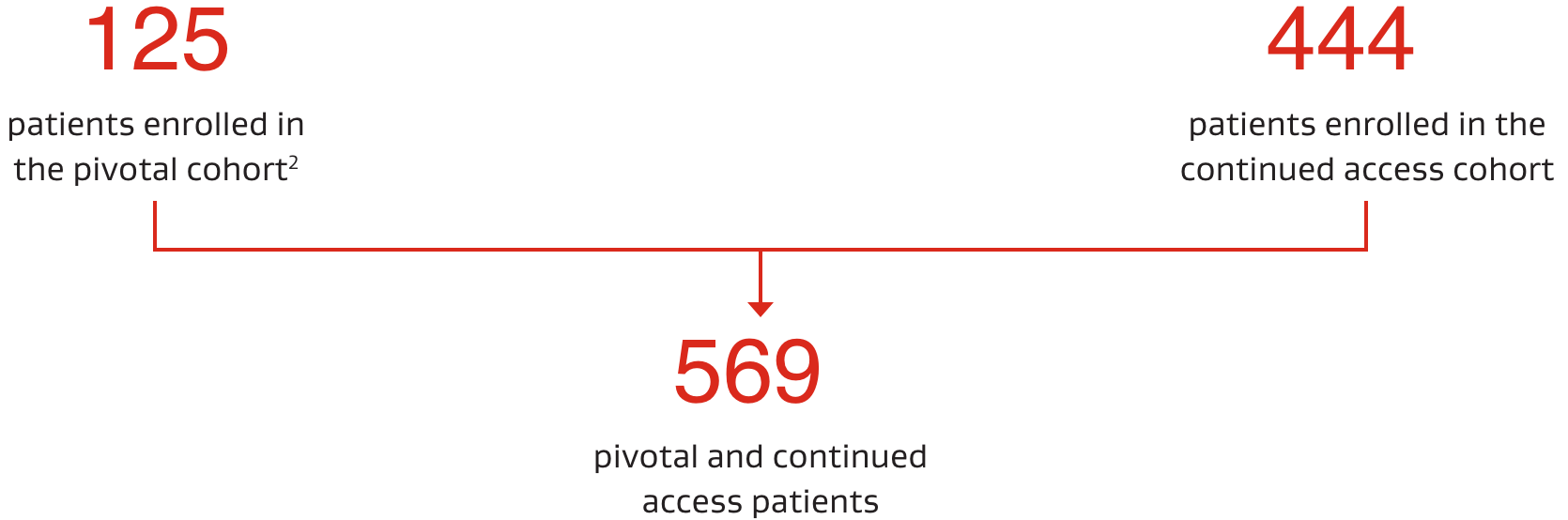
Studiendesign
Die ASSURED-Studie war eine multizentrische, prospektive, einarmige Bewertungsstudie der Sicherheit und Wirksamkeit des CARDIOFORM ASD Occluder bei Patienten mit Ostium-Secundum-Vorhofseptum-Defekten.1
Sekundäre Endpunkte: Erfolg bei Technik† und Eingriff††; langfristiger klinischer Gesamterfolg‡‡; und Verschlusserfolg*, Sicherheitsergebnisse‡ und die Inzidenz klinisch signifikanter neuer Arrhythmien§§ (CSNA) wurden über 36 Monate bewertet1
- Keine Altersbeschränkung
- Ostium-Secundum-Vorhofseptum-Defekte mit einer Größe von 8–35 mm durch Stopflow-Ballontechnik-Größenbestimmung
- Keine Anforderungen an den retroaortalen Rand
- 22 Prüfzentren in den USA
Von März 2017 bis Juli 2019
Konstante Sicherheits- und Wirksamkeitsergebnisse

100 % langfristiger Verschlusserfolg bei einem breiten Spektrum von ASD-Anatomien, darunter Patienten mit schmalen retroaortalen Rändern*,§,II,***,1
Nachweisliche langfristige Sicherheit1
| Langzeitergebnisse nach 36 Monaten | |
|---|---|
| Patienten |
| Geringe 30-Tages-Rate von produkt-/eingriffbezogenen schwerwiegenden unerwünschten Ereignissen (SAE)1 | 3,7 % (21/569) |
| Geringe Rate von Ereignissen durch das Implantat nach 36 MonatenII II, ¶ ¶, 1 | 4,1 % (17/418)II II |
| Geringe Rate klinisch signifikanter neu aufgetretener Herzrhythmusstörungen§§,1 | 4,2 % (24/569) |
0
Keine berichteten kardialen Erosion nach 36 Monaten1
0
Keine berichteten Implantatembolisationen oder Thromben nach 6 Monaten1
0
Keine berichteten klinischen Folgen aufgrund von Frakturen des Drahtgerüsts in der ASSURED klinischen Studie1
Nächste Schritte
* Verschlusserfolg ist definiert als klinischer Restdefektstatus eines Verschlusses oder klinisch nicht signifikant gemäß der Bestimmung durch das Echo Core Lab nach der 36-monatigen Bewertung von Patienten mit technischem Erfolg.
†Technischer Erfolg ist definiert als erfolgreiche Freisetzung und Retention (bei Abschluss des Indexeingriffs) eines GORE® CARDIOFORM ASD Occluder.
‡ Sicherheitsergebnisse sind definiert als Berechnung des Anteils der Patienten, bei denen innerhalb von 30 Tagen nach dem Indexeingriff ein oder mehrere SAE auftraten, oder bei denen es innerhalb von 6 Monaten, 12 Monaten und 36 Monaten nach dem Indexeingriff zu einem Ereignis durch das Implantat (Embolisation, Entfernung des Implantats, Reintervention nach Abschluss des Indexeingriffs) kam.
§ Ein schmaler retroaortaler Rand wurde als retroaortaler Rand definiert, der in jeder Ansicht des Echokardiogramms weniger als oder gleich 5 mm misst.
IIAlle ASD-Anatomien innerhalb der indizierten Größenparameter gemäß Gebrauchsanweisung.
¶Verschlusserfolg ist definiert als klinischer Restdefektstatus eines Verschlusses oder klinisch nicht signifikant gemäß der Bestimmung durch das Echo Core Lab nach der 6-monatigen Bewertung von Patienten mit technischem Erfolg.
**Sicherheitserfolg ist definiert als Freiheit von allen schwerwiegenden unerwünschten Ereignissen (SAE) im Zusammenhang mit dem Implantat oder dem Eingriff (nach Beurteilung durch das Independent Data Review Board (IDRB)) bis 30 Tage nach dem Eingriff sowie Freiheit von Ereignissen durch das Implantat (Embolisation nach dem Eingriff, Entfernung des Implantats oder andere produktrelevante Reinterventionen) ab Abschluss des Implantationseingriffs bis 6 Monate (180 Tage) nach dem Eingriff.
††Operationserfolg ist definiert als technischer Erfolg und als gemessener Restdefektstatus (okkludiert, klein oder moderat) des Ziel-ASD am Ende des Indexeingriffs.
‡‡ Der klinische Gesamterfolg wurde nach 12 Monaten und 36 Monaten bewertet.
§§ Bei Patienten ohne Herzrhythmusstörungen in der Anamnese: jede neu aufgetretene Herzrhythmusstörung (im EKG dokumentiert), die einen Krankenhausaufenthalt erfordert, Beginn einer neuen langfristigen medizinischen Therapie (Dauer > 45 Tage) oder jeglicher Post-index-Eingriff bezüglich Kardioversion oder Intervention (Herzschrittmacher, Ablation usw.).
II II Rate der Ereignisse durch das Implantat (n = 17/418) bei Patienten, bei denen der Endpunkt des klinischen Gesamterfolgs nach 36 Monaten bewertet wurde.
¶ ¶ Ereignisse durch das Implantat sind definiert als Embolisation nach dem Eingriff, Entfernung des Implantats oder andere produktrelevante Reinterventionen ab Abschluss des Implantationseingriffs bis 6 Monate (180 Tage) und 36 Monate (1095 Tage) nach dem Eingriff.
***Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
- Qureshi AM, Sommer RJ, et al; GORE ASSURED Clinical Trial Investigators. Long-term results of the Atrial Septal Defect Occluder ASSURED Trial for combined pivotal/continued access cohorts. JACC: Cardiovascular Interventions 2024;17(19):2274-2283.
- Sommer RJ, Love BA, Paolillo JA, et al. ASSURED clinical study: New GORE® CARDIOFORM ASD occluder for transcatheter closure of atrial septal defect. Catheter & Cardiovascular Interventions. 2020;95:1285-1295.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Der GORE® CARDIOFORM ASD Occluder ist ein dauerhaft eingesetztes Implantat und für den perkutanen katheterbasierten Verschluss von Ostium-Secundum-Vorhofseptum-Defekten (ASD) indiziert.
KONTRAINDIKATIONEN: Die Verwendung des GORE® CARDIOFORM ASD Occluder ist bei folgenden Patienten kontraindiziert:
- Patienten, die keine Thrombozytenaggregationshemmer oder Antikoagulanzien einnehmen können, wie z. B. Acetylsalicylsäure (ASS), Heparin oder Marcumar.
- Anatomische Gegebenheiten bei Patienten, bei denen die Größe oder die Position des GORE® CARDIOFORM ASD Occluder andere intrakardiale oder intravaskuläre Strukturen wie Herzklappen oder Lungenvenen beeinträchtigen würde.
- Patienten mit akuter Endokarditis, mit anderen zu Bakteriämie führenden Infektionen oder bei bekannter Sepsis während des letzten Monats vor der geplanten Implantation oder mit irgendeiner anderen Infektion, die vor der Platzierung eines Verschlussimplantats nicht erfolgreich behandelt werden kann.
- Bei bekannten intrakardialen Thromben.