Dati clinici per l'occlusore GORE® CARDIOFORM ASD Occluder
Gore ASSURED Clinical Study


Gore ASSURED Clinical Study: Risultati a 36 mesi
L'occlusore GORE® CARDIOFORM ASD Occluder continua a dimostrare un profilo di sicurezza e prestazioni cliniche ben consolidati, sulla base di un utilizzo clinico pluridecennale con oltre 15.000 dispositivi venduti a livello globale per la chiusura percutanea dei difetti del setto interatriale (DIA) tipo ostium secundum. ***,1
Il disegno di Gore ASSURED Clinical Study è stato concepito per valutare la sicurezza e l'efficacia dell'occlusore GORE® CARDIOFORM ASD Occluder.
Prestazioni affidabili a lungo termine
100% di percentuale di successi nella chiusura a 36 mesi in pazienti con successo tecnico*,†,1
Risultati di sicurezza comprovati
Risultati di sicurezza coerenti‡ in un ampio spettro di anatomie di DIA, compresi in pazienti con rim retroaortici insufficienti§,II,***,1
Disegno dello studio clinico
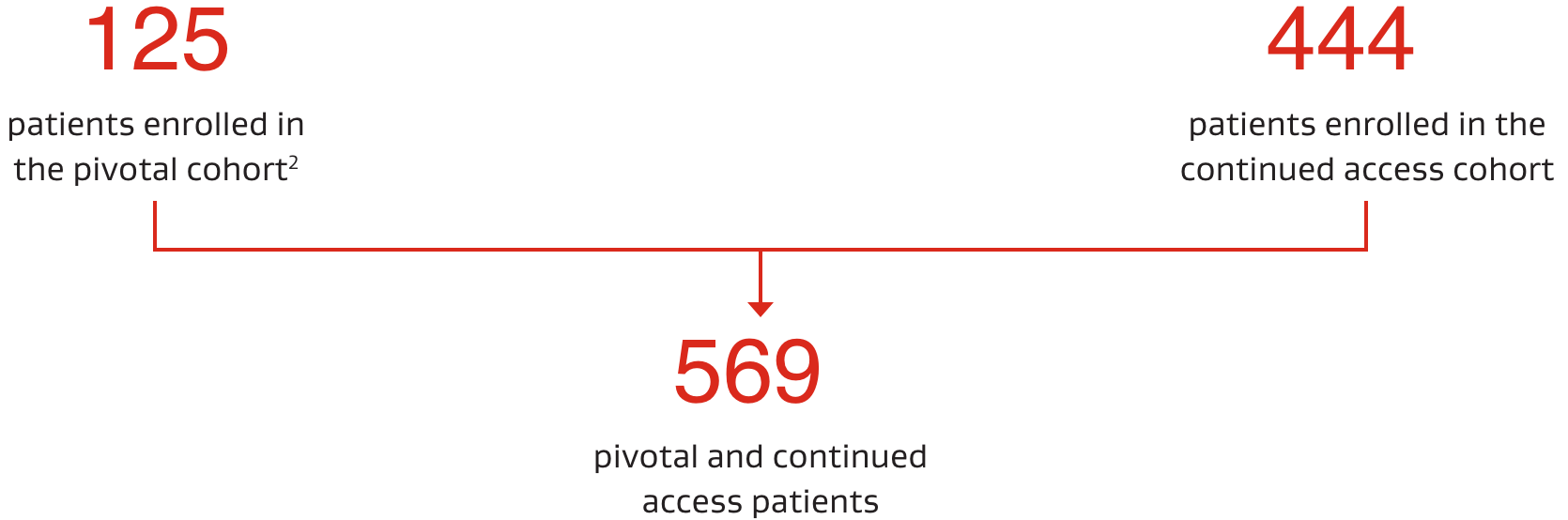
Lo studio ASSURED era una valutazione multicentrica, prospettica, a braccio singolo della sicurezza ed efficacia dell'occlusore CARDIOFORM ASD Occluder in pazienti con DIA tipo ostium secundum.1
Endpoint secondari: Sono stati valutati fino a 36 mesi il successo tecnico† e della procedura††; il successo clinico composto a lungo termine‡‡; e il successo nella chiusura*, i risultati di sicurezza‡ e l'incidenza di nuova aritmia significativa§§ (CSNA)1
- Nessun limite d'età
- DIA tipo ostium secundum di 8–35 mm determinati dalla misurazione del pallone con arresto del flusso
- Assenza di requisiti di rim retroaortico
- 22 centri negli Stati Uniti
Tra marzo 2017 e luglio 2019
Risultati di sicurezza ed efficacia coerenti

100% di successi nella chiusura a lungo termine in un ampio spettro di anatomie di DIA, compresi in pazienti con rim retroaortici insufficienti*,§,II,***,1
Sicurezza comprovata a lungo termine1
| Risultati a lungo termine a 36 mesi | |
|---|---|
| Pazienti |
| Bassa percentuale di eventi avversi seri (SAE) correlati al dispositivo/alla procedura a 30 giorni1 | 3,7% (21/569) |
| Bassa percentuale di eventi correlati al dispositivo a 36 mesiII II, ¶ ¶, 1 | 4,1% (17/418)II II |
| Bassa percentuale di nuove aritmie clinicamente significative§§,1 | 4,2% (24/569) |
0
Assenza di erosioni cardiache segnalate a 36 mesi1
0
Assenza di embolizzazioni o trombi del dispositivo oltre 6 mesi1
0
Assenza di conseguenze cliniche segnalate causate da rottura della struttura metallica nello studio ASSURED Clinical Study1
Fasi successive
* Per successo nella chiusura si intende uno stato clinico di occlusione o non significatività clinica del difetto residuo, determinato dall'Echo Core Lab alla valutazione a 36 mesi tra soggetti con successo tecnico.
†Per successo tecnico si intende il successo del rilascio e della ritenzione (alla fine dell'intervento indice) di un occlusore GORE® CARDIOFORM ASD Occluder.
‡Per risultati di sicurezza si intende un calcolo della percentuale di soggetti che hanno manifestato uno o più SAE nei 30 giorni post-intervento indice o in evento del dispositivo (embolizzazione, rimozione del dispositivo, reintervento a partire dalla fine l'intervento indice) fino a 6, 12 e 36 mesi post-intervento indice.
§Per rim retroaortico insufficiente si intende un rim retroaortico la cui misura è pari o inferiore a 5 mm su qualsiasi visualizzazione dell'ecocardiogramma.
IITutte le anatomie di DIA rientrano nei parametri di sizing indicati nelle Istruzioni per l'uso.
¶Per successo nella chiusura si intende uno stato clinico di occlusione o non significatività clinica del difetto residuo, determinato dall'Echo Core Lab alla valutazione a 6 mesi tra soggetti con successo tecnico.
**Per successo della sicurezza si intende assenza di qualsiasi evento avverso serio (SAE) correlato al dispositivo o alla procedura (come confermato dal Comitato indipendente per la revisione dei dati (IDRB)) fino a 30 giorni post-intervento e assenza di eventi del dispositivo (embolizzazione, rimozione del dispositivo o altro reintervento sul dispositivo) a partire dalla fine della procedura di impianto fino a 6 mesi (180 giorni) post-intervento.
††Per successo dell'intervento si intende il successo tecnico e lo stato di occluso, piccolo o moderato del difetto residuo misurato del DIA target alla fine dell'intervento indice.
‡‡Successo clinico composto valutato a 12 mesi e 36 mesi.
§§ In soggetti con precedente anamnesi di aritmia, qualsiasi nuova aritmia (documentata dall'ECG) che necessita di ricovero in ospedale, avvio di nuova terapia medica a lungo termine (che persiste > 45 giorni) o di qualsiasi cardioversione o intervento effettuato dopo l'intervento indice (pacemaker, ablazione, ecc.).
II II Tasso di eventi del dispositivo (n = 17/418) tra i pazienti valutati per l'endpoint di successo clinico composto a 36 mesi.
¶ ¶Per eventi del dispositivo si intende embolizzazione, rimozione del dispositivo o altro reintervento sul dispositivo post-intervento a partire dalla fine della procedura d'impianto fino a 6 mesi (180 giorni) e 36 mesi (1095 giorni) post-intervento.
***Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
- Qureshi AM, Sommer RJ, et al; GORE ASSURED Clinical Trial Investigators. Long-term results of the Atrial Septal Defect Occluder ASSURED Trial for combined pivotal/continued access cohorts. JACC: Cardiovascular Interventions 2024;17(19):2274-2283.
- Sommer RJ, Love BA, Paolillo JA, et al. ASSURED clinical study: New GORE® CARDIOFORM ASD occluder for transcatheter closure of atrial septal defect. Catheter & Cardiovascular Interventions. 2020;95:1285-1295.

Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
INDICAZIONI PER L'USO IN EUROPA: L'occlusore GORE® CARDIOFORM ASD Occluder è un occlusore impiantabile, indicato per la chiusura percutanea transcatetere dei difetti del setto interatriale (DIA) ostium secundum.
CONTROINDICAZIONI: L'occlusore GORE® CARDIOFORM ASD Occluder è controindicato per l'uso in pazienti:
- che non possono assumere medicinali antipiastrinici o anticoagulanti come aspirina, eparina o warfarin;
- nella cui anatomia la dimensione o la posizione dell'occlusore GORE® CARDIOFORM ASD Occluder interferirebbe con altre strutture intracardiache o intravascolari, come valvole cardiache o vene polmonari;
- che presentano endocardite in atto o altre infezioni che inducono batteriemia, o pazienti con nota diagnosi di sepsi nel mese precedente all'intervento programmato o qualsiasi altra infezione che non può essere trattata con successo prima del posizionamento della protesi;
- con nota diagnosi di trombi intracardiaci.