Occlusore GORE® CARDIOFORM ASD Occluder
DIA con rim retroaortici insufficienti* richiedono una percentuale di chiusure del 100%† e assenza di erosioni1


Il 60% di pazienti sottoposti a chiusura transcatetere del DIA presenta, secondo quanto riportato, rim retroaortici insufficienti.*,2
Dei pazienti arruolati nello studio Gore ASSURED Clinical Study, il 56,4% presenta, secondo quanto riportato, rim retroaortici insufficienti (< 5 mm) ed è stato trattato con l'occlusore GORE® CARDIOFORM ASD Occluder.*,1
L'occlusore GORE® CARDIOFORM ASD Occluder ha ottenuto il 100% di successi nella chiusura† a 36 mesi, senza segnalazioni d incidenti di erosione cardiaca.1
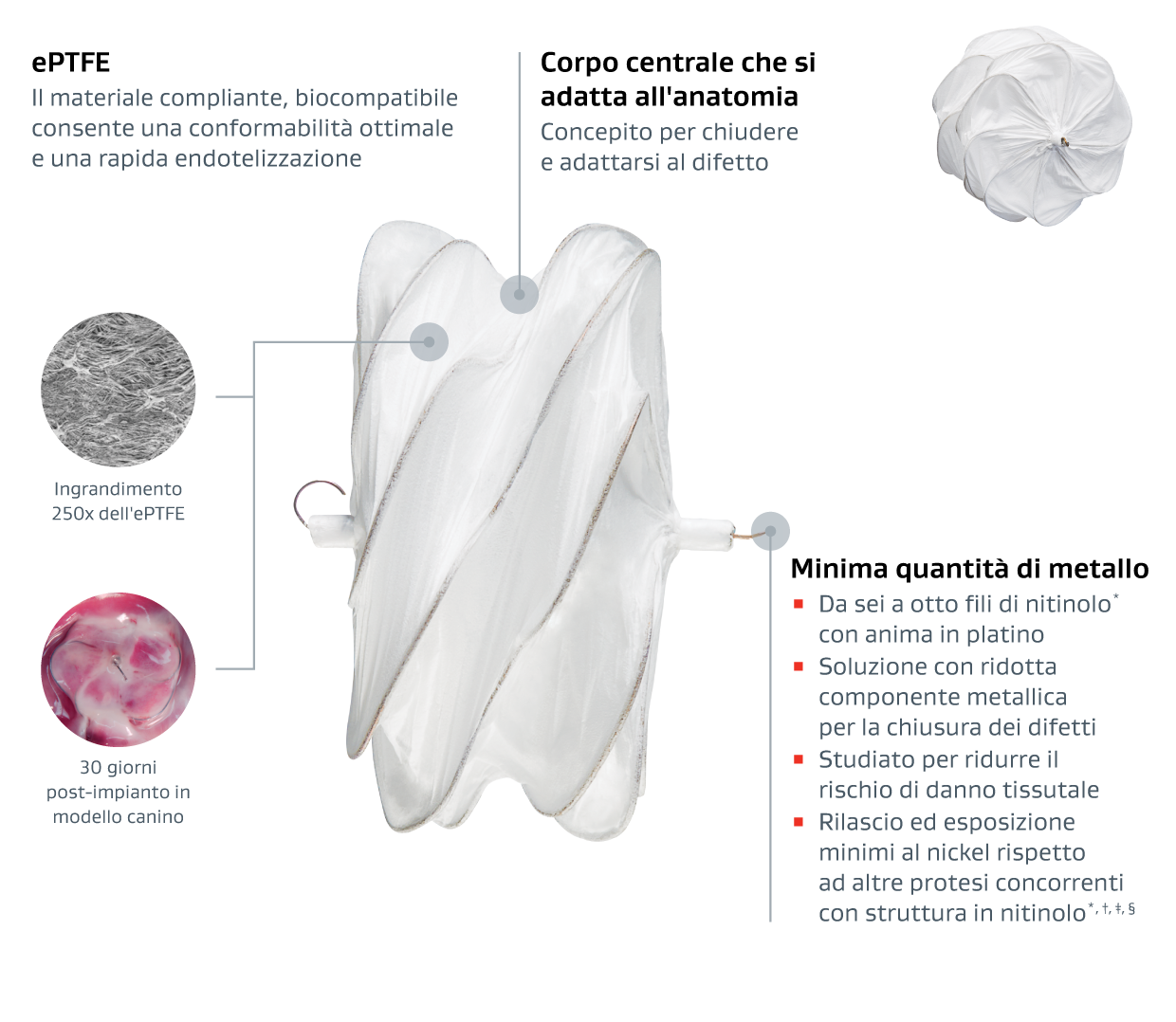
L'occlusore GORE® CARDIOFORM ASD Occluder è un occlusore impiantabile, indicato per la chiusura percutanea transcatetere dei difetti del setto interatriale (DIA) ostium secundum.
Materiali innovativi che offrono eccezionale conformabilità †, ‡, §,1
- Sviluppati da un'azienda con oltre 60 anni di esperienza nella scienza dei materiali
- Concepiti per conformarsi a un ampio spettro di anatomie di DIA ‡,1,**
Assenza di requisiti minimi di rim retroaortico**
Risultati di sicurezza coerenti ‡ in un ampio spettro di anatomie di DIA‡,1,**
I risultati dello studio Gore ASSURED Clinical Study a 3 anni, composti da dalle coorti combinate cardine (N = 125) e accesso continuo (N = 444), continuano a dimostrare il 100% di successi nella chiusura con l'occlusore GORE® CARDIOFORM ASD Occluder, e risultati di sicurezza coerenti in un ampio spettro di anatomie di DIA, compresi i pazienti con rim retroaortici insufficienti. *, †, ‡, ‡‡,1,**
- Assenza di erosioni del dispositivo segnalate1
- 100% di chiusure efficaci in un ampio spettro di anatomie di DIA a 36 mesi †, ‡,1,**
- Assenza di embolizzazioni o trombi del dispositivo segnalati oltre 6 mesi1
- Assenza di conseguenze cliniche segnalate causate da rottura della struttura metallica1
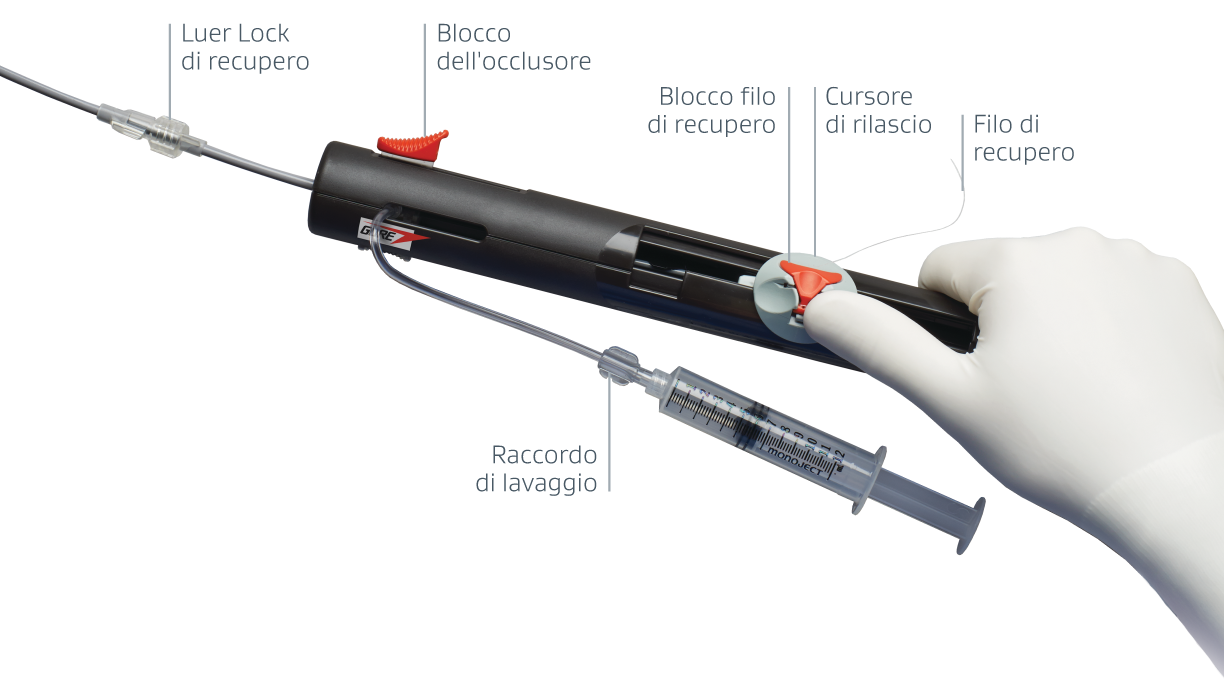
Il filo di recupero integrato consente la valutazione in assenza di tensione e, se necessario, la rimozione dopo il bloccaggio.**
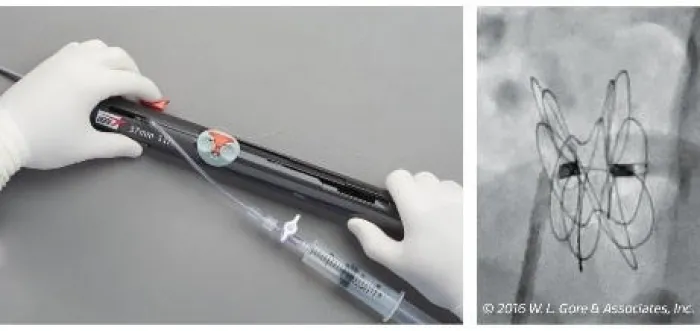
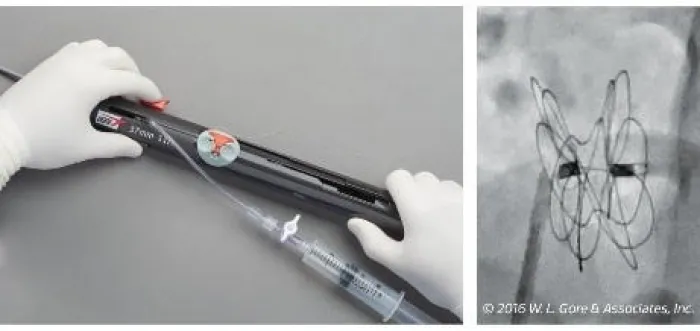
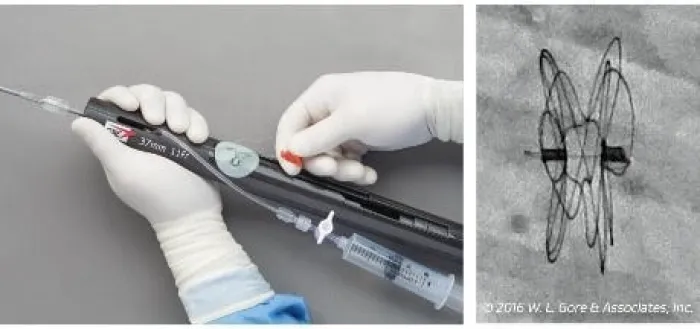
Guardi come viene rilasciato l'occlusore GORE® CARDIOFORM ASD Occluder
Sequenza di rilascio 1-2-3**
Correlati a questo prodotto
* Per rim retroaortico insufficiente si intende un rim retroaortico la cui misura è pari o inferiore a 5 mm su qualsiasi visualizzazione dell'ecocardiogramma.
† Per successo nella chiusura si intende uno stato clinico di occlusione o non significatività clinica del difetto residuo, determinato dall'Echo Core Lab alla valutazione a 36 mesi tra soggetti con successo tecnico.
‡ Tutte le anatomie di DIA erano eleggibili per l'inclusione nello studio Gore ASSURED Clinical Study entro i parametri di sizing indicati nelle Istruzioni per l'uso.
§ 100% di percentuale di successi nella chiusura in tutte le anatomie di DIA a 36 mesi.†, ‡ ,**
II Nichel titanio.
¶ I pazienti allergici al nickel potrebbero manifestare una reazione allergica all'occlusore GORE® CARDIOFORM ASD Occluder. Alcune reazioni allergiche possono essere gravi; i pazienti devono essere informati di rivolgersi immediatamente ai medici curanti se sospettano di manifestare una reazione allergica, come respirazione difficoltosa o infiammazione del volto o della gola. Alcuni pazienti potrebbero sviluppare un'allergia al nickel se questo dispositivo viene impiantato.
** Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
†† Dati in archivio; W. L. Gore & Associates, Inc; Flagstaff, AZ.
‡‡ Per risultati di sicurezza si intende un calcolo della percentuale di soggetti che hanno manifestato uno o più SAE nei 30 giorni post-intervento indice o un evento del dispositivo (embolizzazione, rimozione del dispositivo, reintervento a partire dalla fine l'intervento indice) fino a 6, 12 e 36 mesi post-intervento indice.
- Qureshi AM, Sommer RJ, et al; GORE ASSURED Clinical Trial Investigators. Morgan G, Long-term results of the Atrial Septal Defect Occluder ASSURED Trial for combined pivotal/continued access cohorts. JACC: Cardiovascular Interventions 2024;17(19):2274-2283.
- O’Byrne ML, Glatz AC, Sunderji S, et al. Prevalence of deficient retro-aortic rim and its effects on outcomes in device closure of atrial septal defects. Pediatric Cardiology 2014;35(7):1181-11.

Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
INDICAZIONI PER L'USO IN EUROPA: L'occlusore GORE® CARDIOFORM ASD Occluder è un occlusore impiantabile, indicato per la chiusura percutanea transcatetere dei difetti del setto interatriale (DIA) ostium secundum.
CONTROINDICAZIONI: L'occlusore GORE® CARDIOFORM ASD Occluder è controindicato per l'uso in pazienti:
- che non possono assumere medicinali antipiastrinici o anticoagulanti come aspirina, eparina o warfarin;
- nella cui anatomia la dimensione o la posizione dell'occlusore GORE® CARDIOFORM ASD Occluder interferirebbe con altre strutture intracardiache o intravascolari, come valvole cardiache o vene polmonari;
- che presentano endocardite in atto o altre infezioni che inducono batteriemia, o pazienti con nota diagnosi di sepsi nel mese precedente all'intervento programmato o qualsiasi altra infezione che non può essere trattata con successo prima del posizionamento della protesi;
- con nota diagnosi di trombi intracardiaci.