GORE® CARDIOFORM ASD Occluder
Vorhofseptumdefekte mit schmalen retroaortalen Rändern* erfordern einen 100%igen Verschluss† ohne Erosionen1


60 % der Patienten mit katheterbasiertem Verschluss eines ASD weisen nach Berichten schmale retroaortale Ränder auf.*,2
In der Gore ASSURED klinischen Studie wiesen nach Berichten 56,4 % der Patienten schmale retroaortale Ränder auf (< 5 mm) und wurden mit dem GORE® CARDIOFORM ASD Occluder behandelt.*,1
Der GORE® CARDIOFORM ASD Occluder erreichte nach 36 Monaten einen Verschlusserfolg von 100 %.† Hierbei lagen keine Fälle von kardialer Erosion vor.1
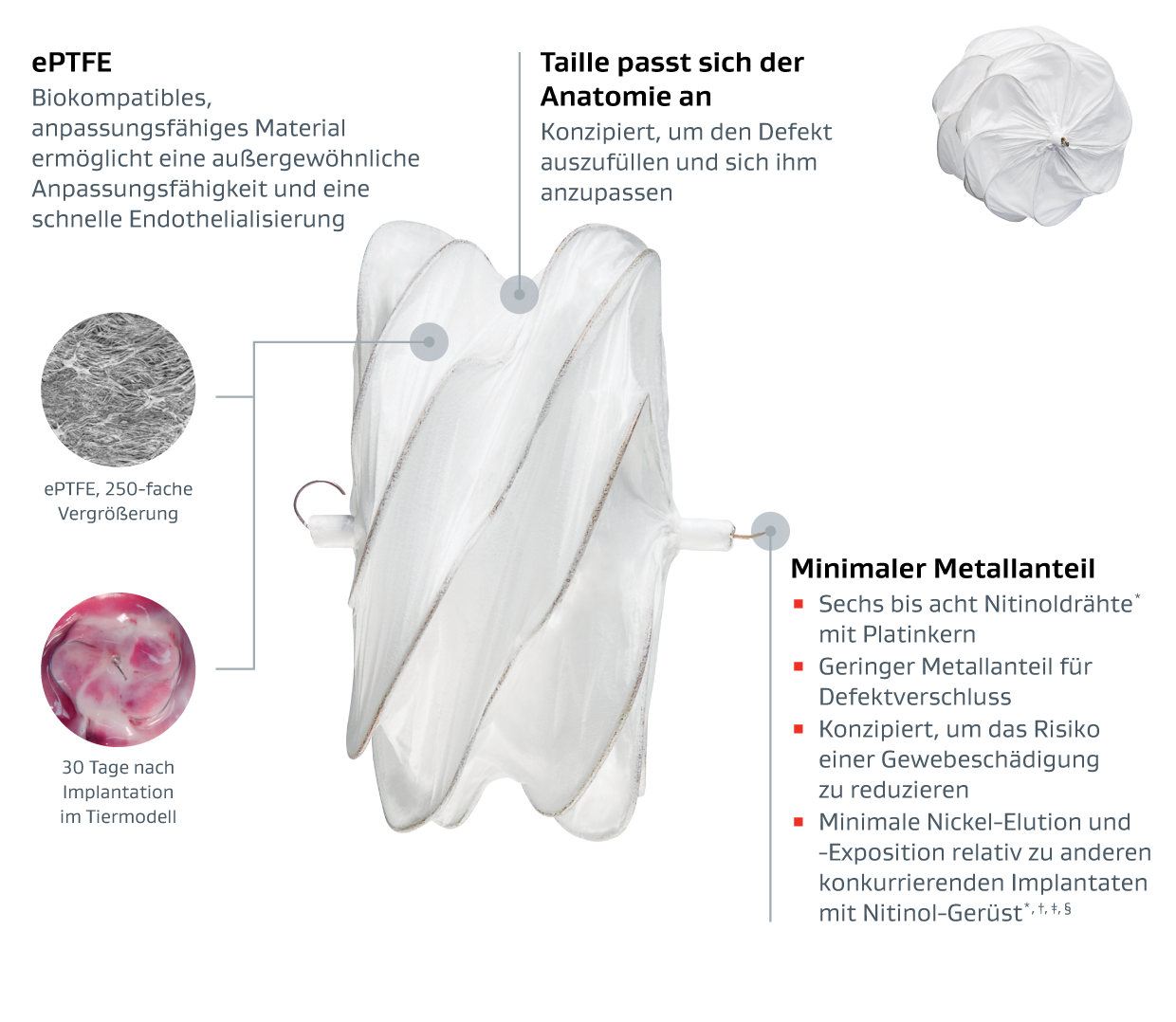
Der GORE® CARDIOFORM ASD Occluder ist ein dauerhaft eingesetztes Implantat und für den perkutanen katheterbasierten Verschluss von Ostium-Secundum-Vorhofseptum-Defekten (ASD) indiziert.
Hochentwickelte Materialien bieten eine außergewöhnliche Anpassungsfähigkeit †, ‡, §,1
- Entwickelt von einem Unternehmen mit 60-jähriger materialwissenschaftlicher Erfahrung
- Entwickelt für die Anpassung an ein breites Spektrum von ASD-Anatomien ‡,1,**
Kein retroaortaler Rand erforderlich**
Konstante Sicherheitsergebnisse ‡‡ bei einem breiten Spektrum von ASD-Anatomien‡,1,**
Die Studienergebnisse der Gore ASSURED klinischen Studie über 3 Jahre, bestehend aus der kombinierten Zulassungskohorte (N = 125) und der Kohorte mit permanentem Zugang (N = 444), zeigen mit dem GORE® CARDIOFORM ASD Occluder weiterhin einen Verschlusserfolg von 100 % sowie konstante Sicherheitsergebnisse bei einem breiten Spektrum von ASD-Anatomien, einschließlich bei Patienten mit einem schmalen retroaortalen Rand. *, †, ‡, ‡‡,1,**
- Keine berichteten kardialen Erosionen1
- 100 % effektive Verschlüsse bei einem breiten Spektrum von ASD-Anatomien nach 36 Monaten †, ‡,1,**
- Keine berichteten Implantatembolisationen oder Thromben nach 6 Monaten1
- Keine berichteten klinischen Folgen aufgrund von Frakturen des Drahtgerüsts in der Studie1
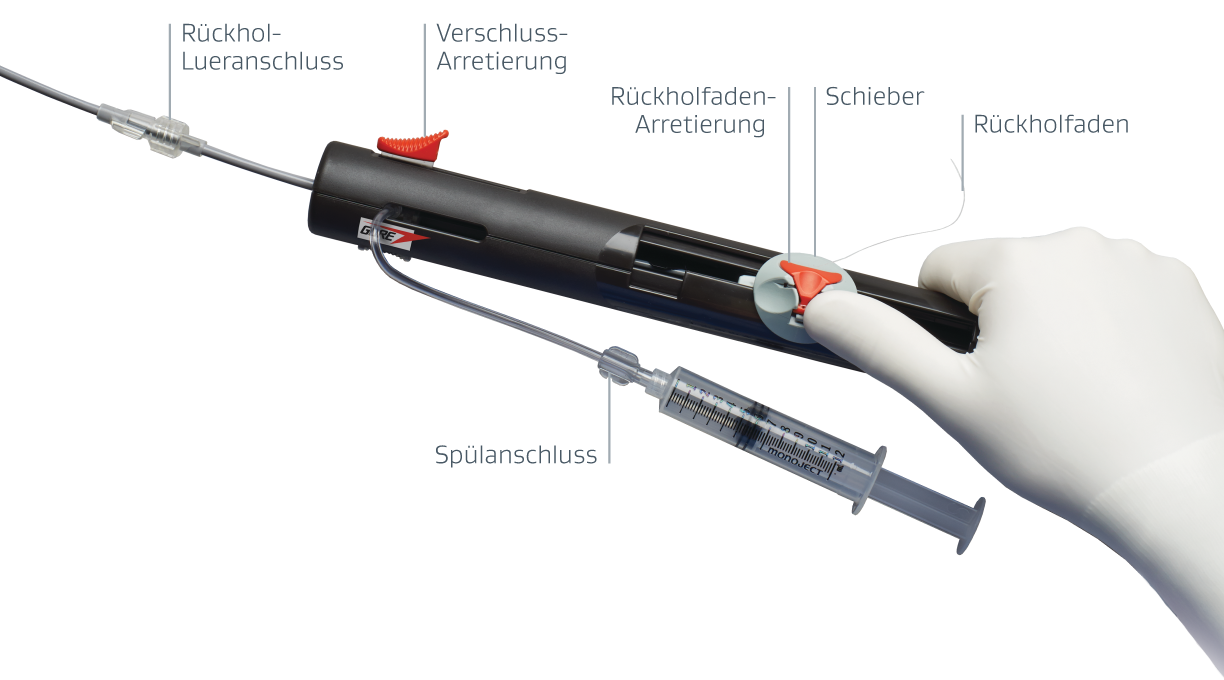
Der integrierte Rückholfaden ermöglicht eine spannungsfreie Beurteilung und Rückholung nach der Verriegelung, falls erforderlich.**
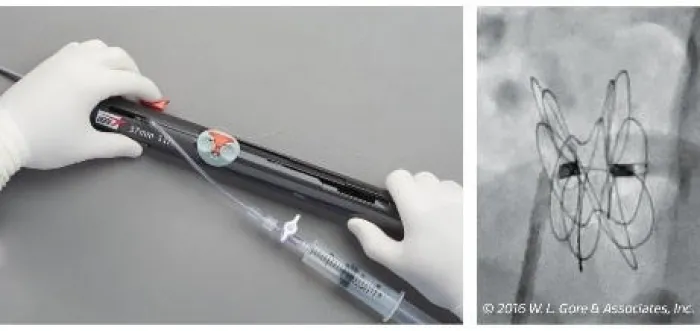
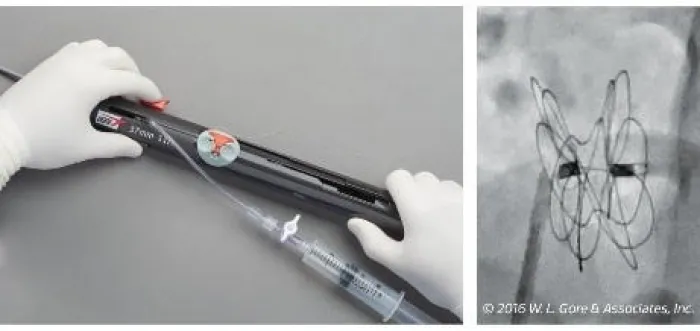
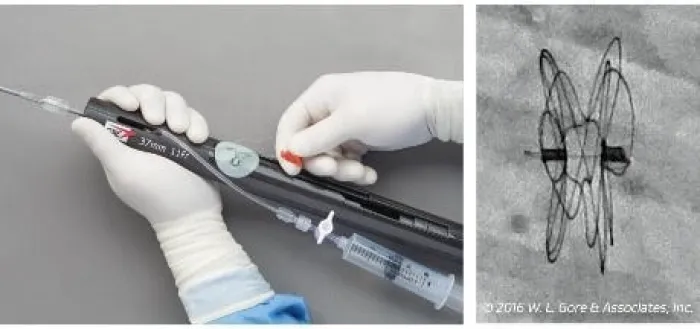
Sehen Sie sich an, wie der GORE® CARDIOFORM ASD Occluder freigesetzt wird.
1–2–3 Implantationsschritte**
Auf dieses Produkt bezogen
* Ein schmaler retroaortaler Rand wurde als retroaortaler Rand definiert, der in jeder Ansicht des Echokardiogramms weniger als oder gleich 5 mm misst.
† Verschlusserfolg ist definiert als klinischer Restdefektstatus eines Verschlusses oder klinisch nicht signifikant gemäß der Bestimmung durch das Echo Core Lab nach der 36-monatigen Bewertung von Patienten mit technischem Erfolg.
‡ Alle ASD-Anatomien waren innerhalb der indizierten Größenparameter gemäß Gebrauchsanweisung für den Einschluss in die klinische ASSURED-Studie geeignet.
§ 100 % Verschlusserfolgsrate bei ASD-Anatomien nach 36 Monaten.†, ‡ ,**
II Nickel-Titan.
¶ Bei Patienten mit Nickelallergie kann eine allergische Reaktion auf den GORE® CARDIOFORM ASD Occluder auftreten. Bestimmte allergische Reaktionen können schwerwiegend sein. Die Patienten sollten angewiesen werden, sofort ihren Arzt aufzusuchen, wenn sie vermuten, dass eine allergische Reaktion wie Atembeschwerden oder Entzündungen im Gesicht oder Rachen aufgetreten ist. Einige Patienten können auch eine Nickelallergie entwickeln, wenn dieses Implantat implantiert wird.
** Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
†† Daten liegen vor. W. L. Gore & Associates, Inc; Flagstaff, AZ.
‡‡ Sicherheitsergebnisse sind definiert als Berechnung des Anteils der Patienten, bei denen innerhalb von 30 Tagen nach dem Indexeingriff ein oder mehrere SAE auftraten, oder bei denen es innerhalb von 6 Monaten, 12 Monaten und 36 Monaten nach dem Indexeingriff zu einem Ereignis durch das Implantat (Embolisation, Entfernung des Implantats, Reintervention nach Abschluss des Indexeingriffs) kam.
- Qureshi AM, Sommer RJ, et al; GORE ASSURED Clinical Trial Investigators. Morgan G, Long-term results of the Atrial Septal Defect Occluder ASSURED Trial for combined pivotal/continued access cohorts. JACC: Cardiovascular Interventions 2024;17(19):2274-2283.
- O’Byrne ML, Glatz AC, Sunderji S, et al. Prevalence of deficient retro-aortic rim and its effects on outcomes in device closure of atrial septal defects. Pediatric Cardiology 2014;35(7):1181-11.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Der GORE® CARDIOFORM ASD Occluder ist ein dauerhaft eingesetztes Implantat und für den perkutanen katheterbasierten Verschluss von Ostium-Secundum-Vorhofseptum-Defekten (ASD) indiziert.
KONTRAINDIKATIONEN: Die Verwendung des GORE® CARDIOFORM ASD Occluder ist bei folgenden Patienten kontraindiziert:
- Patienten, die keine Thrombozytenaggregationshemmer oder Antikoagulanzien einnehmen können, wie z. B. Acetylsalicylsäure (ASS), Heparin oder Marcumar.
- Anatomische Gegebenheiten bei Patienten, bei denen die Größe oder die Position des GORE® CARDIOFORM ASD Occluder andere intrakardiale oder intravaskuläre Strukturen wie Herzklappen oder Lungenvenen beeinträchtigen würde.
- Patienten mit akuter Endokarditis, mit anderen zu Bakteriämie führenden Infektionen oder bei bekannter Sepsis während des letzten Monats vor der geplanten Implantation oder mit irgendeiner anderen Infektion, die vor der Platzierung eines Verschlussimplantats nicht erfolgreich behandelt werden kann.
- Bei bekannten intrakardialen Thromben.