Denken Sie an die Herausforderungen bei der Behandlung komplizierter iliakaler Läsionen
- Multizentrische und prospektive Studien zeigen die suboptimale Leistung von unbeschichteten Metallstents (BMS) bei komplizierten iliakalen Erkrankungen.1-6
- In der COBEST-Studie lag die 5-jährige primäre Offenheitsrate von BMS bei TASC-II-C & D-Läsionen bei ungefähr 25 %.1
- Eine Perforation/Ruptur der Iliakalarterien und der Aortenbifurkation ist nicht ungewöhnlich und kann lebensbedrohlich sein.7,8
- Bei schwerer Verkalkung empfehlen die Operationsleitlinien die Platzierung eines Stent Graft zur Behandlung der Verschlusskrankheit der Iliakalarterien (IOD).9
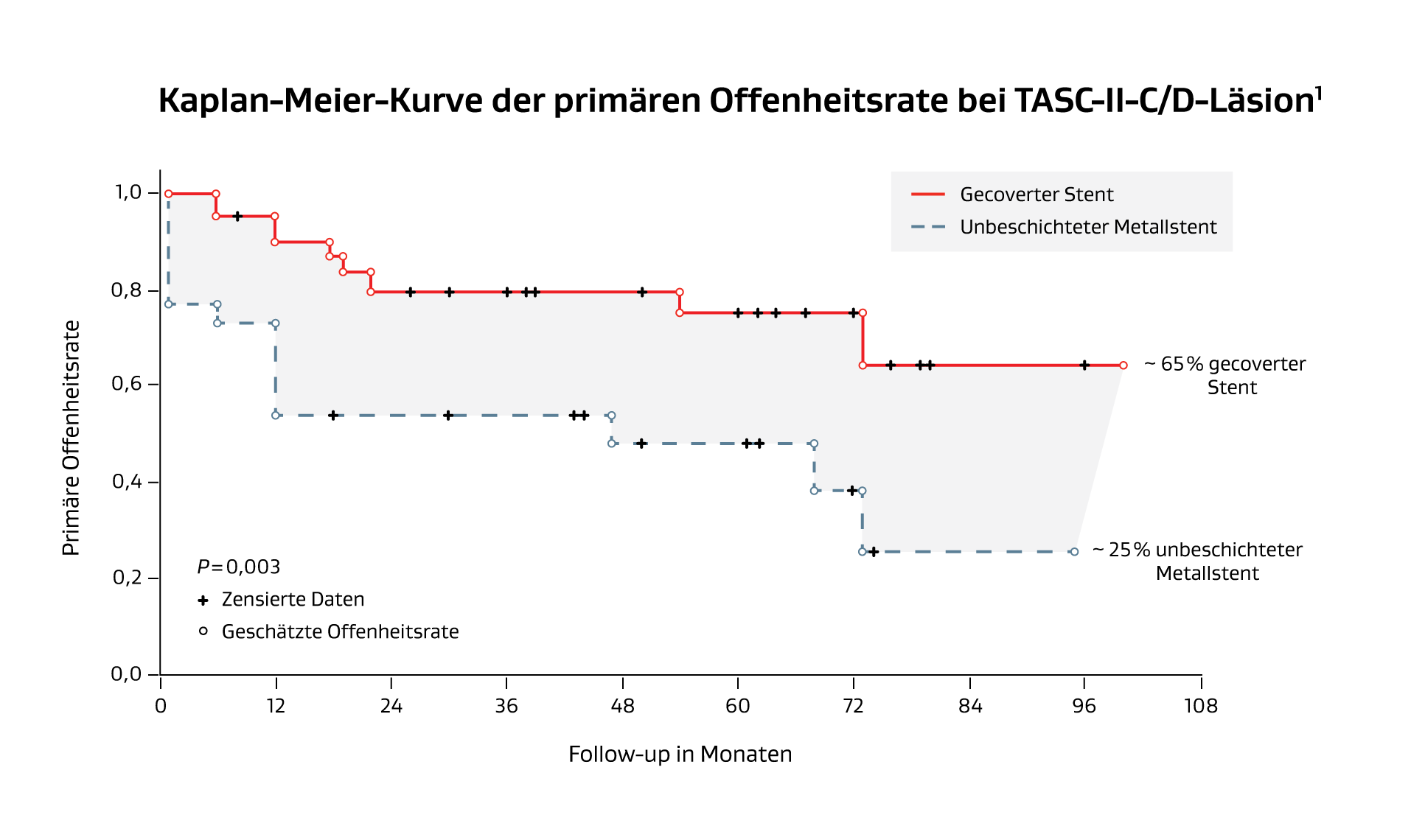
Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche* (VIABAHN® Implantat) und die GORE® VIABAHN® VBX ballonexpandierbare Endoprothese (VBX Endoprothese) haben sich bei der Behandlung der komplizierten IOD nachweislich bewährt.
Nachgewiesene Langlebigkeit
- Bei der Behandlung komplizierter Läsionen der Iliakalarterien haben Endoprothesen eine Überlegenheit gegenüber unbeschichteten Metallstents gezeigt.5,6
- Selbstexpandierende Endoprothesen haben nach drei Jahren eine verbesserte Offenheit gegenüber unbeschichteten Metallstents bei der Behandlung von iliakalen TASC-II-D-Läsionen gezeigt.5
- Ballonexpandierbare Endoprothesen haben nach 5 Jahren eine höhere primäre Offenheitsrate im Vergleich zu unbeschichteten Metallstents gezeigt.1
Nachweisliche Offenheit
- Die VIABAHN® Produktlinie weist Offenheitsraten auf, die sich den veröffentlichten Ergebnissen von operativen Bypässen annähern.
- Das VIABAHN® Implantat zeigte eine 3-jährige primäre Offenheitsrate von 89,8 %.10
- Die VBX Endoprothese zeigte eine 1-jährige primäre Offenheitsrate von 94,5 %.11
- Die Übersicht einer Metaanalyse von 3.733 Patienten mit offener Bypass-Operation aus 29 Studien zeigte eine gepoolte primäre Offenheitsrate von 95 %.8
Basierend auf früheren klinischen Daten. Aktuelle Neubewertung des Stentsystems mit verringertem Profil.
* Bioaktive PROPATEN Oberfläche bezieht sich bei Gore auf die firmeneigene CBAS®‑Heparin‑Oberfläche.
1. Mwipatayi BP, Sharma S, Daneshmand A, et al; COBEST co-investigators. Durability of the balloon-expandable covered versus bare-metal stents in the Covered versus Balloon Expandable Stent Trial (COBEST) for the treatment of aortoiliac occlusive disease. Journal of Vascular Surgery 2016;64(1):83-94.e1.
2. Mwipatayi BP, Thomas S, Wong J, et al; Covered Versus Balloon Expandable Stent Trial (COBEST) Co-investigators. A comparison of covered vs bare expandable stents for the treatment of aortoiliac occlusive disease. Journal of Vascular Surgery 2011;54(6):1561-1570.
3. Sabri SS, Choudhri A, Orgera G, et al. Outcomes of covered kissing stent placement compared with bare metal stent placement in the treatment of atherosclerotic occlusive disease at the aortic bifurcation. Journal of Vascular & Interventional Radiology 2010;21(7):995-1003.
4. Piazza M, Squizzato F, Spolverato G, et al. Outcomes of polytetrafluoroethylene-covered stent versus bare-metal stent in the primary treatment of severe iliac artery obstructive lesions. Journal of Vascular Surgery 2015;62(5):1210-1218.e1
5. Piazza M, Squizzato F, Dall’Antonia A, et al. Outcomes of self expanding PTFE covered stent versus bare metal stent for chronic iliac artery occlusion in matched cohorts using propensity score modelling. European Journal of Vascular & Endovascular Surgery 2017;54(2):177-185.
6. Chang RW, Goodney PP, Baek JH, Nolan BW, Rzucidlo EM, Powell RJ. Long-term results of combined common femoral endarterectomy and iliac stenting/stent grafting for occlusive disease. Journal of Vascular Surgery 2008;48(2):362-367.
7. Jongkind V, Akkersdijk GJ, Yeung KK, Wisselink W. A systematic review of endovascular treatment of extensive aortoiliac occlusive disease. Journal of Vascular Surgery 2010;52(5):1376-1383.
8. Indes JE, Pfaff MJ, Farrokhyar F, et al. Clinical outcomes of 5358 patients undergoing direct open bypass or endovascular treatment for aortoiliac occlusive disease: a systematic review and meta-analysis. Journal of Endovascular Therapy 2013;20(4):443-455.
9. Society for Vascular Surgery Lower Extremity Guidelines Writing Group; Conte MS, Pomposelli FB, et al; Society for Vascular Surgery. Society for Vascular Surgery practice guidelines for atherosclerotic occlusive disease of the lower extremities: Management of asymptomatic disease and claudication. Journal of Vascular Surgery 2015;61(3)Supplement: 2S-41S.e1.
10. Squizzato, F., Mosquera-Rey, V., Zanabili Al-Sibbai, A. et al. Outcomes of Self-Expanding Covered Stents for the Treatment of External ILIAC Artery Obstructive Disease. Cardiovasc Intervent Radiol 46, 579–587 (2023).
11. Panneton JM, Bismuth J, Gray BH, Holden A. Three-year follow-up of patients with iliac occlusive disease treated with the Viabahn Balloon-Expandable Endoprosthesis. Journal of Endovascular Therapy 2020;27(5):728-736. https://journals.sagepub.com/doi/10.1177/1526602820920569
12. GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche Gebrauchsanweisung. W. L. Gore & Associates, Inc. Letzter Zugriff am 17. September 2024. https://eifu.goremedical.com
13. GORE® VIABAHN® VBX ballonexpandierbare Endoprothese Gebrauchsanweisung. W. L. Gore & Associates, Inc. Letzter Zugriff am 10. Juli 2025. https://eifu.goremedical.com

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche:
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien
- De-novo-Läsionen oder restenotische Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Restenotische In-Stent-Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Stenose oder thrombotischer Verschluss an der venösen Anastomose synthetischer arteriovenöser Gefäßprothesen (AV-Zugänge) und im venösen Abstrom bei Shunts von Dialysezugängen, einschließlich der zentralen Venen
- Poplitealarterienaneurysmen und isolierte Viszeralarterienaneurysmen
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis)
KONTRAINDIKATIONEN:
- Nicht-elastische Läsionen, bei denen während der Prädilatation keine vollständige Aufdehnung des Angioplastie-Ballonkatheters erzielt wurde bzw. bei denen die Läsion nicht ausreichend aufgedehnt werden kann, um die Passage des Applikationssystems zu ermöglichen.
- Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht verwendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.
GORE® VIABAHN® VBX ballonexpandierbare Endoprothese:
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® VBX ballonexpandierbare Endoprothese ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien, einschließlich Läsionen an der Aortenbifurkation;
- De-novo-Läsionen oder restenotische Läsionen der Viszeralarterien;
- Isolierte Aneurysmen der Viszeralarterien, Iliakalarterien und Subklaviaarterien;
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotis, A. Vertebralis- und A. Pulmonalis).
Die GORE® VIABAHN® VBX ballonexpandierbare Endoprothese ist zur Verwendung als Bridging Stent bei Behandlungen von gebranchten und fenestrierten endovaskulären Aortenaneurysmen mit den folgenden Produkten indiziert:
- Zugelassene gebranchte endovaskuläre Aortenprothesen, bestehend aus Polyestergewebe, Edelstahlstents und Polypropylen-Nahtmaterial, wobei die Branchkomponenten einen Durchmesser von 6/8 mm und eine Länge von 18/21 mm aufweisen.
- Zugelassene fenestrierte endovaskuläre Aortenprothesen, bestehend aus Polyestergewebe, Edelstahlstents und Fenestrationen aus Polypropylen-Nahtmaterial, wobei der Durchmesserbereich bei 6–8 mm liegt.
KONTRAINDIKATIONEN: Die GORE® VIABAHN® VBX ballonexpandierbare Endoprothese darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht angewendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.
GORE® VIABAHN® VBX ballonexpandierbare Endoprothese (mit verringertem Profil)
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® VBX ballonexpandierbare Endoprothese ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien, einschließlich Läsionen an der Aortenbifurkation;
- De-novo-Läsionen oder restenotische Läsionen der Viszeralarterien;
- Isolierte Aneurysmen der Viszeralarterien, Iliakalarterien und Subklaviaarterien;
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraumoder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis).
KONTRAINDIKATIONEN: Die GORE® VIABAHN® VBX ballonexpandierbare Endoprothese darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht angewendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.