Rivestimento con l'endoprotesi GORE® VIABAHN® con superficie bioattiva PROPATEN* come terapia di prima linea nel trattamento di ristenosi intrastent (ISR) complesse
Uno studio dei casi che utilizzano la protesi VIABAHN®
Problematica clinica
- Nel 2007, il paziente (età 72 anni) ha presentato claudicazione necessitante di crioplastica dell'arteria femorale superficiale (SFA)
- Il paziente è stato sottoposto a numerosi reinterventi in un periodo di 11 anni:
- Meno di tre mesi dal trattamento iniziale — I sintomi sono ricomparsi. Il paziente è stato trattato con aterectomia laser all'iato adduttore ed è stato posizionato uno stent metallico nudo in nitinolo autoespandibile di 7 x 100 mm.
- 2011 — Sintomi ricorrenti a causa della ISR trattata con aterectomia laser e la semplice e tradizionale angioplastica con pallone (POBA)
- 2012 — Ripetizione dell'aterectomia laser e della POBA
- 2015 — Dispnea debilitante e ricomparsa della malattia distale basata sul calo dell'indice caviglia-braccio ed elevata velocità duplex con Rapporto > 2; Nessun intervento periferico è stato effettuato, poiché l'ischemia dell'arto era meno sintomatica della coronaropatia
- 2018 — Successo della sostituzione transcatetere della valvola aortica e sollievo della dispnea. Il paziente ha ripresentato notevole claudicazione nelle distanze brevi, con incapacità di completare la riabilitazione cardiaca; ISR con velocità sistolica di picco > 400 cm/s
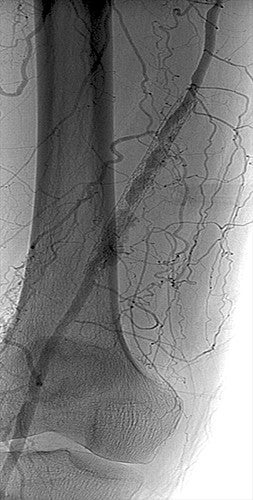
Procedura
- A causa di molteplici tentativi di aterectomia e POBA precedenti, procedura è stata avviata con l'intenzione di rivestire gli stent metallici nudi (BMS) con la protesi VIABAHN®
- Si è ottenuto l'accesso controlaterale per eseguire l'aortografia ed escludere patologie da afflusso/deflusso
- Dopo l'anticoagulazione, è stata posizionata una guida TERUMO® DESTINATION® da 6 Fr
- L'angiografia ha confermato la ISR con deflusso di due vasi attraverso le grandi arterie tibiale anteriore e peroneale e una certa progressione prossimale della malattia dell'SFA
- ISR attraversata con catetere di supporto SPECTRANETICS QUICK-CROSS® da 0,035" e guida TERUMO® GLIDEWIRE®
- Un dispositivo con protezione embolica MEDTRONIC SPIDERFX da 7 mm è stato posizionato attraverso il catetere di supporto SPECTRANETICS QUICK-CROSS®
- Pretrattato con una POBA da 5 x 100 mm compresa la nuova malattia prossimale al vecchio stent
- Per primo si è posizionata una protesi VIABAHN® da a 6 mm x 15 cm, a cui è stata successivamente sovrapposta una protesi VIABAHN® da 6 mm x 10 cm
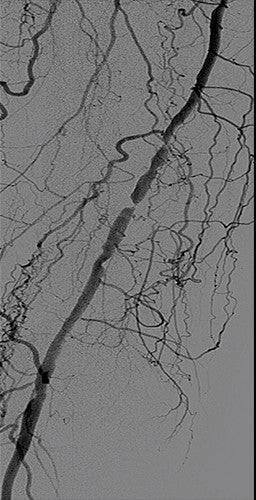
Risultato
- Procedura completata senza stenosi residua significativa e assenza di embolizzazione del deflusso
- A causa dell'età e del viaggio, il paziente è stato ricoverato per una notte e dimesso la mattina successiva con palpazione del polso dorso-pedidio
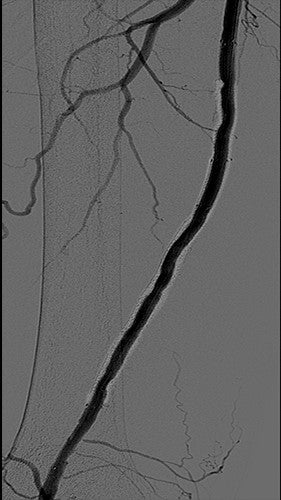
Punti chiave del caso
Per ogni ISR complessa dell'SFA, il rivestimento con endoprotesi ricoperte è diventata una procedura di riferimento come terapia di prima linea. Lo studio clinico Gore RELINE con protesi VIABAHN® ha mostrato un'elevata pervietà primaria anche nella malattia più complessa: 75% di pervietà primaria a 12 mesi con una lunghezza media della lesione di oltre 17 cm.1 In questo caso di malattia da ISR, il rivestimento del BMS con una protesi VIABAHN® ha generato un risultato favorevole e ha escluso con successo l'iperplasia neointimale associata alla ISR del BMS.
Studio dei casi correlato
* Come inteso da GORE, superficie bioattiva PROPATEN si riferisce alla superficie eparinata CBAS® di proprietà di Gore.
- Bosiers M, Deloose K, Callaert J, et al. Superiority of stent-grafts for in-stent restenosis in the superficial femoral artery: twelve-month results from a multicenter randomized trial. Journal of Endovascular Therapy 2015;22(1):1-10.
TERUMO, DESTINATION e GLIDEWIRE sono marchi commerciali di Terumo Medical Corporation.
SPECTRANETICS e QUICK-CROSS sono marchi commerciali di Spectranetics Corp.
MEDTRONIC e SPIDERFX sono marchi commerciali di Medtronic, Inc.
I risultati e le osservazioni segnalati sono basati sull'esperienza di casi individuali e sui pazienti trattati. Le fasi descritte in questo articolo potrebbero non essere complete e non sono destinate a sostituire né le Istruzioni per l'uso, né l'istruzione, la formazione e il giudizio professionale degli healthcare provider. Gli healthcare provider rimangono responsabili delle decisioni prese riguardanti la cura dei pazienti e l'uso delle tecnologie mediche.

Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
INDICAZIONI PER L'USO IN EUROPA: L'endoprotesi GORE® VIABAHN® con superficie bioattiva PROPATEN è indicata per il trattamento di:
- lesioni de novo o ristenotiche delle arterie iliache
- lesioni de novo o ristenotiche dell'arteria femorale superficiale e dell'arteria poplitea prossimale
- lesioni ristenotiche intrastent dell'arteria femorale superficiale e dell'arteria poplitea prossimale
- stenosi o occlusione trombotica nell'anastomosi venosa della protesi sintetica per l'accesso arterovenoso (AV) e nel deflusso venoso dei circuiti di accesso per dialisi, comprese le vene centrali
- aneurismi dell'arteria poplitea e aneurismi isolati delle arterie viscerali
- lesioni vasali traumatiche o iatrogene delle arterie che sono posizionate nella cavità toracica, addominale o pelvica (con l'eccezione di aorta, coronarie, tronco arterioso brachiocefalico, carotidi, arterie vertebrali e polmonari)
CONTROINDICAZIONI:
- Nelle lesioni non complianti, laddove un pallone per angioplastica non abbia raggiunto l'espansione completa durante la predilatazione, oppure qualora fosse impossibile dilatare le lesioni in misura sufficiente per consentire il passaggio del sistema di rilascio.
- L'endoprotesi GORE® VIABAHN® con superficie bioattiva PROPATEN non deve essere utilizzata in pazienti con nota ipersensibilità all'eparina, compresi i pazienti che hanno manifestato un precedente evento di trombocitopenia indotta da eparina (HIT) di tipo II.


