In der RELINE-Studie wurde die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche* als Erstlinientherapie bei der Behandlung komplizierter In-Stent-Restenosen (ISR) eingesetzt
Eine Fallstudie mit dem GORE® VIABAHN® Implantat
Herausforderung
- Im Alter von 72 Jahren stellte sich der Patient 2007 mit Claudicatio vor und benötigte eine Kryoplastie der A. femoralis superficialis (AFS).
- Über einen Zeitraum von 11 Jahren erhielt der Patient mehrere Reinterventionen:
- Weniger als 3 Monate nach der Erstbehandlung kehrten die Symptome zurück. Der Patient wurde am Hiatus adductorius mit Laser-Atherektomie behandelt und ein 7 x 100 mm selbstexpandierender unbeschichteter Metall-Nitinol-Stent wurde platziert.
- 2011 – Rezidivierende Symptome aufgrund von ISR, behandelt mit Laser-Atherektomie und klassischer Ballon-Angioplastie (POBA, plain old balloon angioplasty).
- 2012 – Wiederholte Laser-Atherektomie und POBA.
- 2015 – Belastende Dyspnoe und Rezidiv der distalen Erkrankung aufgrund eines Abfalls des Knöchel-Arm-Index und einer erhöhten Duplexgeschwindigkeit des Verhältnisses > 2. Es wurde keine periphere Intervention vorgenommen, da die Extremitätenischämie weniger symptomatisch war als die koronare Herzkrankheit.
- 2018 – Erfolgreicher katheterbasierter Aortenklappenersatz und Linderung der Dyspnoe. Der Patient stellte sich erneut vor mit signifikanter Claudicatio bei kurzen Strecken und der Unfähigkeit, die kardiologische Rehabilitation abzuschließen. ISR mit systolischer Spitzengeschwindigkeit von > 400 cm/s.
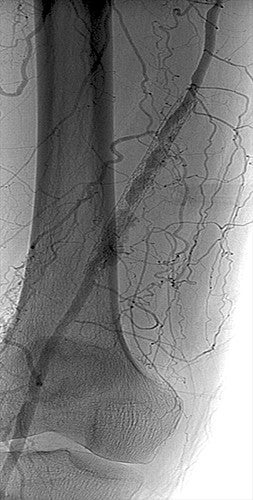
Verfahren
- Aufgrund mehrerer vorheriger Versuche einer Atherektomie und POBA wurde der Eingriff mit der Absicht begonnen, ein Relining der unbeschichteten Metallstents (BMS) mit dem VIABAHN® Implantat durchzuführen.
- Es erfolgte ein kontralateraler Zugang zur Durchführung einer Aortografie und zum Ausschluss einer Erkrankung des Zu- und Abstroms.
- Nach Antikoagulation wurde eine 6 Fr TERUMO® DESTINATION® Führungsschleuse eingebracht.
- Die Angiografie bestätigte eine ISR mit zwei Gefäßabströmen über die große vordere A. tibialis und A. peronea und einer gewissen proximalen Progression der AFS-Erkrankung.
- Durchquerung mit 0,035 Zoll SPECTRANETICS QUICK-CROSS® Trägerkatheter und TERUMO® GLIDEWIRE® Führungsdraht.
- Ein 7 mm MEDTRONIC SPIDERFX Embolieschutz-Katheter wurde durch den SPECTRANETICS QUICK-CROSS® Trägerkatheter platziert.
- Vorbehandlung mit einer 5 x 100 mm POBA, einschließlich neuer Erkrankung in der Nähe des alten Stents.
- Zunächst wurde ein 6 mm x 15 cm VIABAHN® Implantat freigesetzt und anschließend mit einem 6 mm x 10 cm VIABAHN® Implantat überlappt.
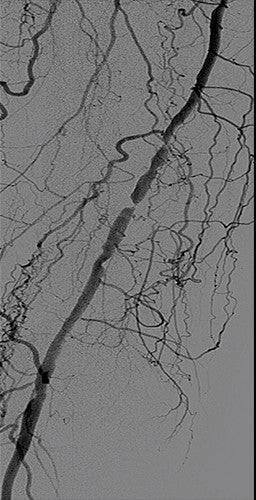
Ergebnis
- Beendigung ohne signifikante Reststenose und ohne Embolisation des Abstroms.
- Aufgrund seines Alters und seiner Reisesituation wurde der Patient über Nacht stationär aufgenommen und am nächsten Morgen mit einem tastbaren dorsalen Fußpuls entlassen.
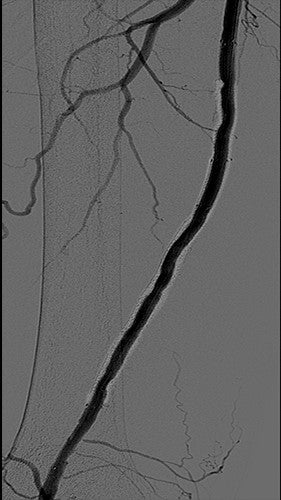
Fallpunkte
Bei komplizierten AFS-ISR ist das Relining mit gecoverten Endoprothesen inzwischen das Verfahren der Wahl als Erstlinientherapie. Die Gore RELINE klinische Studie mit dem VIABAHN® Implantat zeigte eine hohe primäre Offenheitsrate selbst bei schwierigster Erkrankung: Primäre Offenheitsrate über 12 Monate von 75 % mit einer durchschnittlichen Läsionslänge von mehr als 17 cm.1 Bei diesem ISR-Fall bewirkte das Relining des unbeschichteten Metallstents mit einem VIABAHN® Implantat ein günstiges Ergebnis und einen erfolgreichen Ausschluss der Neointimahyperplasie, die mit der ISR des unbeschichteten Metallstents in Zusammenhang stand.
Relevante Fallstudie
* Bioaktive PROPATEN Oberfläche bezieht sich bei Gore auf die firmeneigene CBAS®‑Heparin‑Oberfläche.
- Bosiers M, Deloose K, Callaert J, et al. Superiority of stent-grafts for in-stent restenosis in the superficial femoral artery: twelve-month results from a multicenter randomized trial. Journal of Endovascular Therapy 2015;22(1):1-10.
TERUMO, DESTINATION und GLIDEWIRE sind Markenzeichen von Terumo Medical Corporation.
SPECTRANETICS und QUICK-CROSS sind Markenzeichen von Spectranetics Corp.
MEDTRONIC und SPIDERFX sind Markenzeichen von Medtronic, Inc.
Die Ergebnisse und Beobachtungen, über die berichtet wird, beruhen auf den Erfahrungen mit einzelnen Fällen sowie mit den behandelten Patienten. Die hier beschriebenen Schritte sind möglicherweise nicht vollständig und sind nicht als Ersatz für die Gebrauchsanweisung oder die Ausbildung, Schulung und das professionelle Urteil von Ärzten/Ärztinnen vorgesehen. Ärzte/Ärztinnen tragen allein die Verantwortung für Entscheidungen zur Behandlung der Patienten und die Verwendung medizinischer Technologien.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien
- De-novo-Läsionen oder restenotische Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Restenotische In-Stent-Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Stenose oder thrombotischer Verschluss an der venösen Anastomose synthetischer arteriovenöser Gefäßprothesen (AV-Zugänge) und im venösen Abstrom bei Shunts von Dialysezugängen, einschließlich der zentralen Venen
- Poplitealarterienaneurysmen und isolierte Viszeralarterienaneurysmen
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis)
KONTRAINDIKATIONEN:
- Nicht-elastische Läsionen, bei denen während der Prädilatation keine vollständige Aufdehnung des Angioplastie-Ballonkatheters erzielt wurde bzw. bei denen die Läsion nicht ausreichend aufgedehnt werden kann, um die Passage des Applikationssystems zu ermöglichen.
- Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht verwendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.


