Behandlung von Claudicatio und Ruheschmerz aufgrund eines chronischen Totalverschlusses der AFS
Eine Fallstudie mit der GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche*
Herausforderung
- 65-jährige Frau mit schwerer peripherer arterieller Verschlusskrankheit, Claudicatio und Ruheschmerz in der linken unteren Extremität.
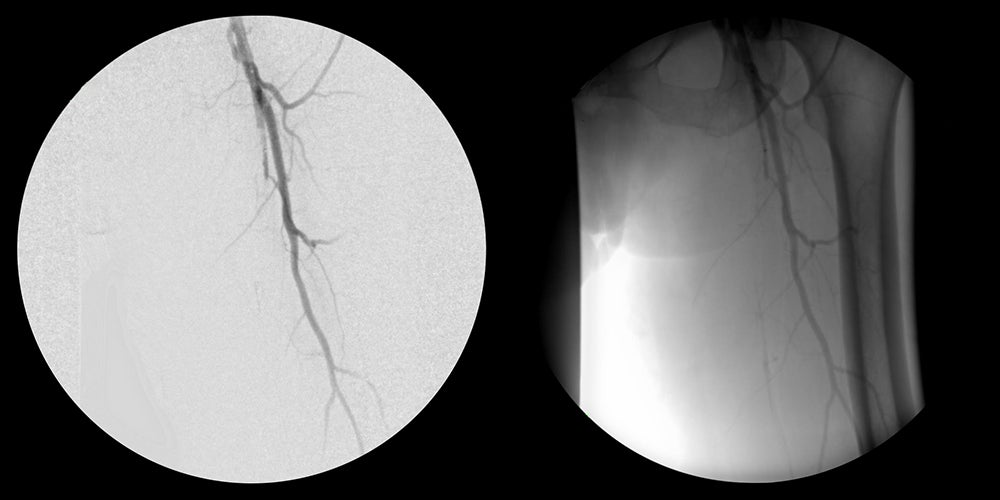
- Die Angiografie zeigte einen Totalverschluss der linken A. femoralis superficialis (AFS).
Verfahren
- Unter Ultraschallkontrolle wurde ein perkutaner Zugang zur rechten Femoralarterie geschaffen. Anschließend wurde eine Angiografie der linken unteren Extremität durchgeführt.
- Der chronische Totalverschluss (CTO) der AFS wurde durchquert mit einem 0,035 Zoll TERUMO® RADIOFOCUS® GLIDEWIRE® ADVANTAGE und einem 0,035 Zoll TERUMO® NAVICROSS® Trägerkatheter.
- Die Atherektomie wurde mit einem CARDIOVASCULAR SYSTEMS DIAMONDBACK 360® Peripheral Orbital Atherektomie-System 2.0 Solid Crown durchgeführt.
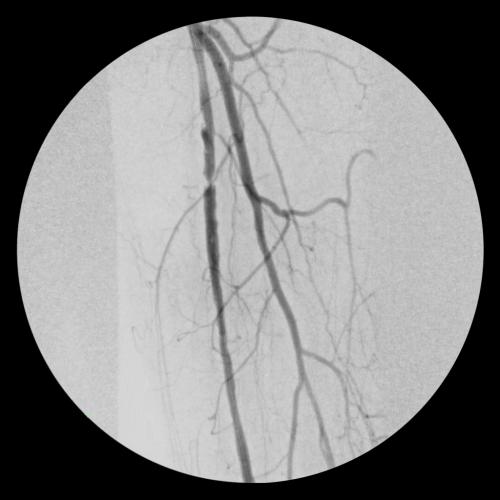
- Es folgte eine Angioplastie mit einem 5-mm-Ballon für die perkutane transluminale Angioplastie (PTA).
- Zwei 6 mm x 15 cm VIABAHN® Implantate wurden in der AFS freigesetzt und es erfolgte eine Postdilatation mit einem 6-mm-PTA-Ballon.
Ergebnis
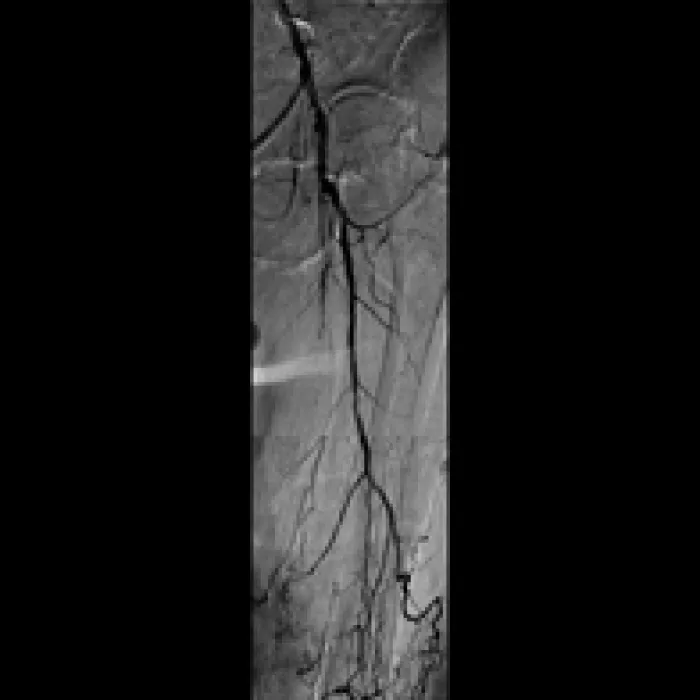
- Die abschließende Angiografie zeigte einen ausgezeichneten Blutfluss der linken unteren Extremität. Unmittelbar nach der Operation bestand die vollständige Behebung der linksseitigen schweren Claudicatio.
- Bei der Nachuntersuchung 2,5 Wochen nach der Operation zeigte die Patientin eine vollständige Behebung der Claudicatio und des Ruheschmerzes. Die Patientin hatte beidseitig tastbare Tibiapulse.
Fallpunkte
Wie bei diesem Fall demonstriert, bietet das VIABAHN® Implantat eine ausgezeichnete Offenheit bei der Behandlung langstreckiger AFS-Totalverschlüsse und sollt bei komplizierten AFS-Erkrankungen als Erstlinientherapie in Betracht gezogen werden.
Das VIABAHN® Implantat zeigte Langlebigkeit und langfristige Offenheit bei der Behandlung komplizierter AFS-Erkrankungen mit
97 % sekundärer Offenheit über 3 Jahre
(27 cm durchschnittliche Läsionslänge, 93 % CTO)1
Relevante Fallstudie
* Bioaktive PROPATEN Oberfläche bezieht sich bei Gore auf die firmeneigene CBAS®‑Heparin‑Oberfläche.
- Böhme T, Noory E, Brechtel K, et al. Heparin-bonded stent-graft for the treatment of TASC II C and D femoropopliteal lesions: 36-month results of the Viabahn 25 cm trial. Journal of Endovascular Therapy. 2021;28(2) 222-228. https://journals.sagepub.com/doi/pdf/10.1177/1526602820965965
Diese Inhalte sind nur für Informationszwecke bestimmt. Es handelt sich nicht um eine Beratung oder eine Garantie für das Behandlungsergebnis. Diese Inhalte sind kein Ersatz für eine professionelle medizinische Beratung, Diagnose oder Behandlung. Die einzelnen Ergebnisse und/oder Behandlungen können je nach den Umständen, der spezifischen Situation des Patienten und der medizinischen Beurteilung des Arztes variieren.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien
- De-novo-Läsionen oder restenotische Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Restenotische In-Stent-Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Stenose oder thrombotischer Verschluss an der venösen Anastomose synthetischer arteriovenöser Gefäßprothesen (AV-Zugänge) und im venösen Abstrom bei Shunts von Dialysezugängen, einschließlich der zentralen Venen
- Poplitealarterienaneurysmen und isolierte Viszeralarterienaneurysmen
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis)
KONTRAINDIKATIONEN:
- Nicht-elastische Läsionen, bei denen während der Prädilatation keine vollständige Aufdehnung des Angioplastie-Ballonkatheters erzielt wurde bzw. bei denen die Läsion nicht ausreichend aufgedehnt werden kann, um die Passage des Applikationssystems zu ermöglichen.
- Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht verwendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.