Endovaskuläre Behandlung eines chronischen Verschlusses der A. femoralis superficialis (AFS) zum Extremitätenerhalt
Eine Fallstudie mit der GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche*
Herausforderung
- 83-jährige Frau mit ischämischer Gangrän der rechten Großzehe (Rutherford 6)
- Relevante Patientenanamnese:
- Diabetes, Bluthochdruck, Dyslipidämie, Adipositas, koronare Herzkrankheit, Vorhofflimmern, chronische Nierenerkrankung, chronisch obstruktive Lungenerkrankung (COPD)
- Knöchel-Arm-Index (ABI) supra-systemisch aufgrund verkalkter Tibiaarterien
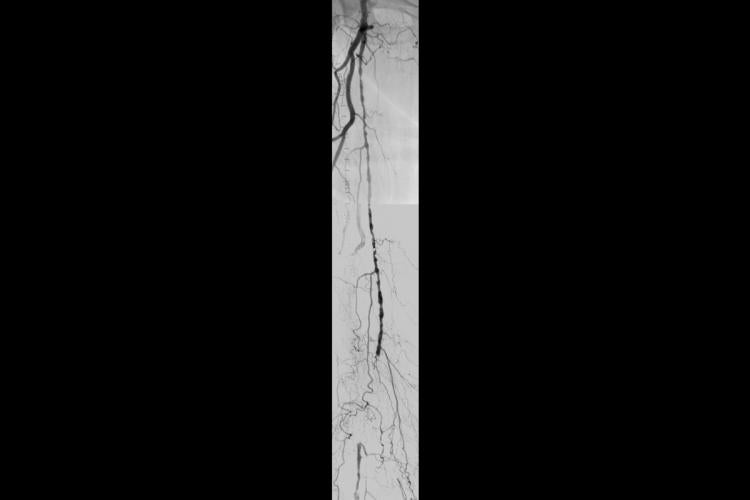
- Anhand von Pulsvolumenaufzeichnungen zeigte sich eine Verschlusskrankheit im femoropoplitealen Segment
Verfahren
- Kontralateraler Zugang zur rechten AFS (05. März 2013)
- Läsion durchquert mit geradem TERUMO GLIDEWIRE® Führungsdraht, gefolgt von der Platzierung eines SPECTRANETICS® QUICK‑CROSS Trägerkatheters
- Perkutane transluminale Angioplastie (PTA) mit 5-mm-Angioplastie-Ballon
Ergebnis
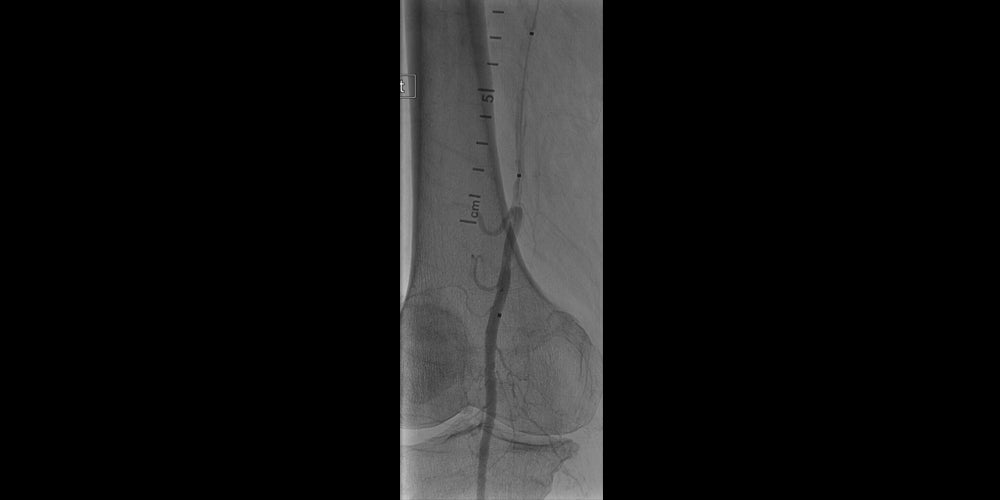
- Proximales Implantat erfolgreich am Ostium der AFS platziert
- Korrekte Größenbestimmung mit 5-mm-Implantat
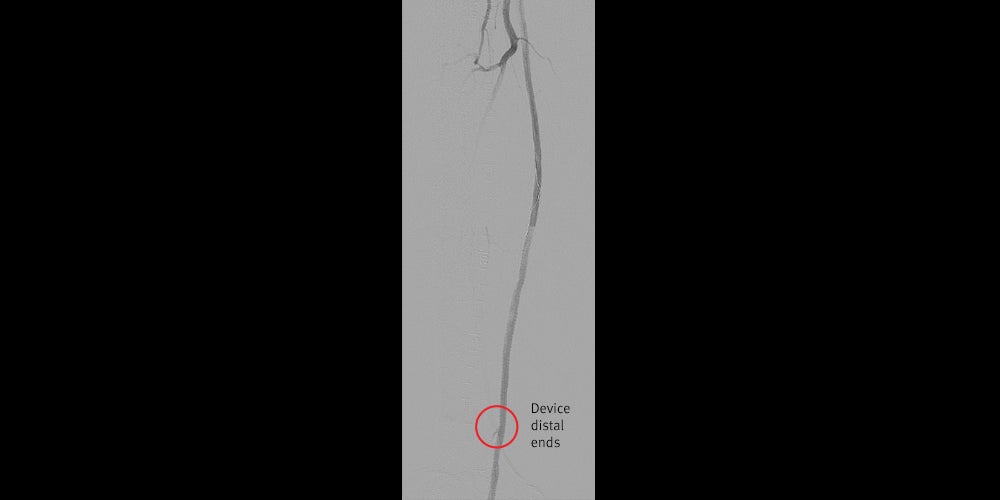
- Ausgezeichnetes Ergebnis in der Röntgenaufnahme
- Geschwür der Patientin heilte nach Intervention
- Offenheit der Endoprothese während der letzten Nachuntersuchung über 18 Monate nach dem Eingriff
Fallpunkte
- Extremitätenerhalt durch endoluminalen Bypass bei Extremität mit Rutherford 6.
- Die anfängliche PTA zeigte zwar ein gutes Ergebnis, jedoch leiden Diabetespatienten an einer diffusen Erkrankung, und die Arteriografie unterschätzt die Belastung durch Plaques bei diesen Patienten.
- Abdeckung von Gewebe „gesund-zu-gesund“ im Rahmen des Möglichen.
* Bioaktive PROPATEN Oberfläche bezieht sich bei Gore auf die firmeneigene CBAS®‑Heparin‑Oberfläche.
TERUMO und GLIDEWIRE sind Markenzeichen von Terumo Medical Corporation.
USPECTRANETICS und QUICK CROSS sind Markenzeichen von Spectranetics Corporation.
Die Ergebnisse und Beobachtungen, über die berichtet wird, beruhen auf den Erfahrungen mit einzelnen Fällen sowie mit den behandelten Patienten. Die hier beschriebenen Schritte sind möglicherweise nicht vollständig und sind nicht als Ersatz für die Gebrauchsanweisung oder die Ausbildung, Schulung und das professionelle Urteil von Ärzten/Ärztinnen vorgesehen. Ärzte/Ärztinnen tragen allein die Verantwortung für Entscheidungen zur Behandlung der Patienten und die Verwendung medizinischer Technologien.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien
- De-novo-Läsionen oder restenotische Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Restenotische In-Stent-Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Stenose oder thrombotischer Verschluss an der venösen Anastomose synthetischer arteriovenöser Gefäßprothesen (AV-Zugänge) und im venösen Abstrom bei Shunts von Dialysezugängen, einschließlich der zentralen Venen
- Poplitealarterienaneurysmen und isolierte Viszeralarterienaneurysmen
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis)
KONTRAINDIKATIONEN:
- Nicht-elastische Läsionen, bei denen während der Prädilatation keine vollständige Aufdehnung des Angioplastie-Ballonkatheters erzielt wurde bzw. bei denen die Läsion nicht ausreichend aufgedehnt werden kann, um die Passage des Applikationssystems zu ermöglichen.
- Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht verwendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.