Langstreckige Läsionen der Femoralarterie (AFS) stellen komplizierte Herausforderungen für die endovaskuläre Behandlung dar
Mit zunehmender Läsionslänge verschlechtern sich in der Regel die Behandlungsergebnisse, und in Studien mit medikamentefreisetzenden Stents, medikamentefreisetzenden Ballons und unbeschichteten Metallstents wird eine verminderte Offenheit nachgewiesen.1-7
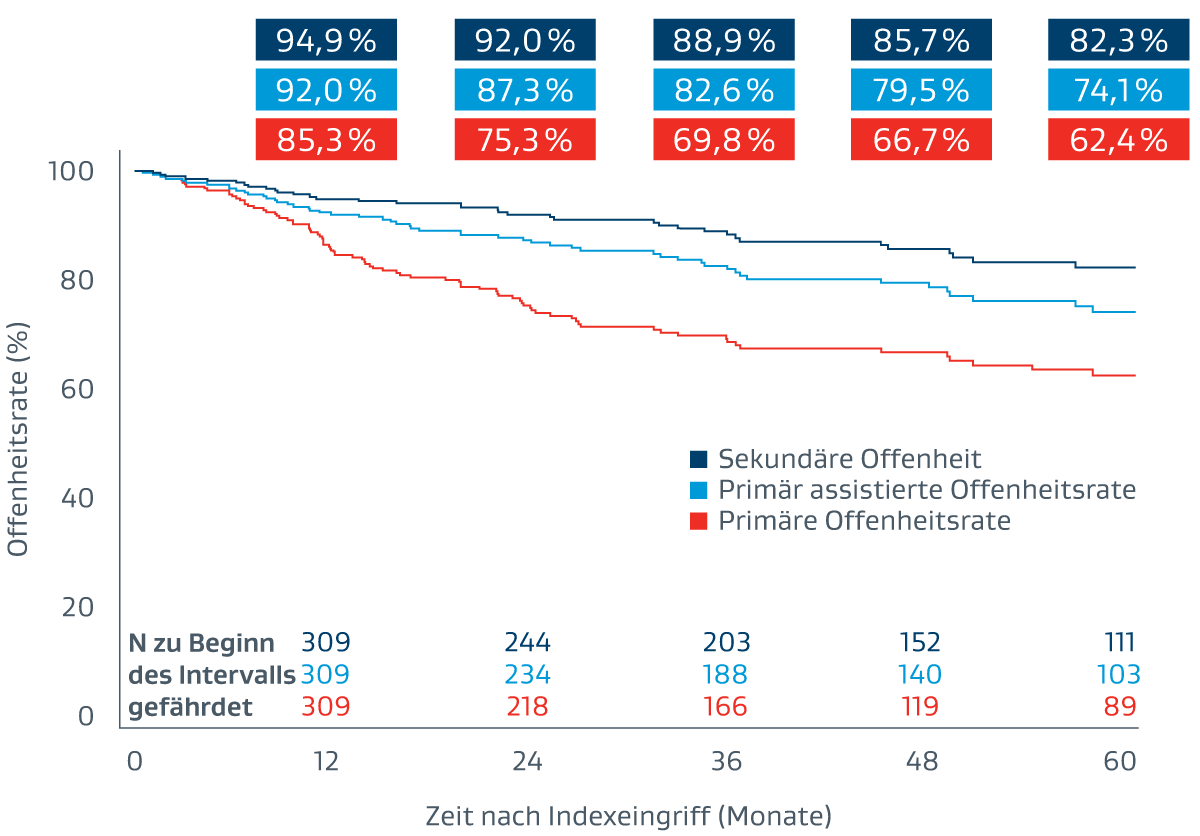
Nachweisbare Ergebnisse bei langstreckigen AFS-Läsionen
Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche* hat unabhängig von der Läsionslänge eine ausgezeichnete Offenheit und Langlebigkeit gezeigt.4, 8-11
Peer-Review-Ergebnisse
Die veröffentlichten Studienergebnisse finden Sie in Vascular Medicine, der offiziellen Fachzeitschrift der Society for Vascular Medicine.
Ziele und Methodik
Prospektive, multizentrische (64 Prüfzentren) 5-Jahres-Follow-up-Studie auf Basis einer 1-jährigen Überwachung nach Markteinführung.12, 13
- 324 Läsionen, 24 cm durchschnittliche Läsionslänge
- 70 % chronische Totalverschlüsse (CTO)
- 27 % kritische Extremitäten-bedrohende Ischämie (CLTI)
- 48 % TASC-II-D-Läsionen
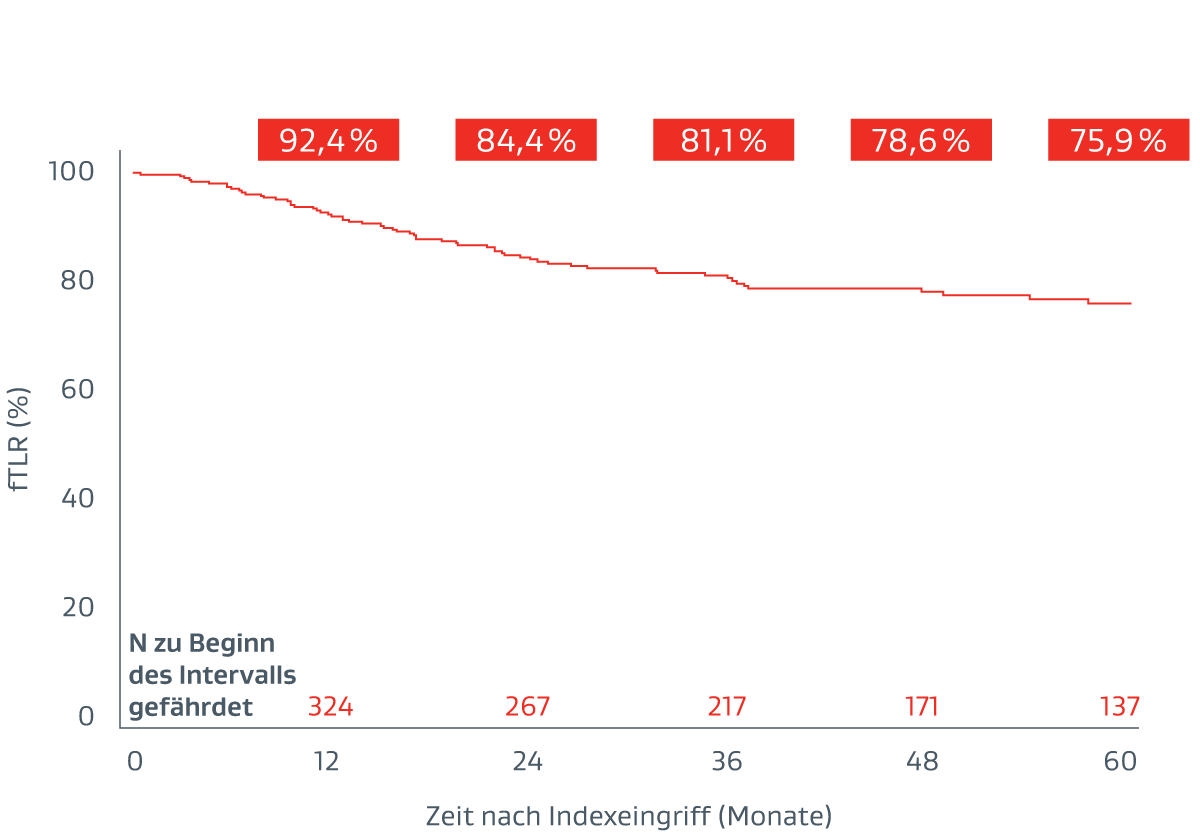
Nachhaltige klinische Ergebnisse
Die folgenden Ergebnisse wurden erstmals während der Sitzung zu aktuellen klinischen Studien bei der VIVA 2023 vorgestellt.
Ergebnisse anzeigen
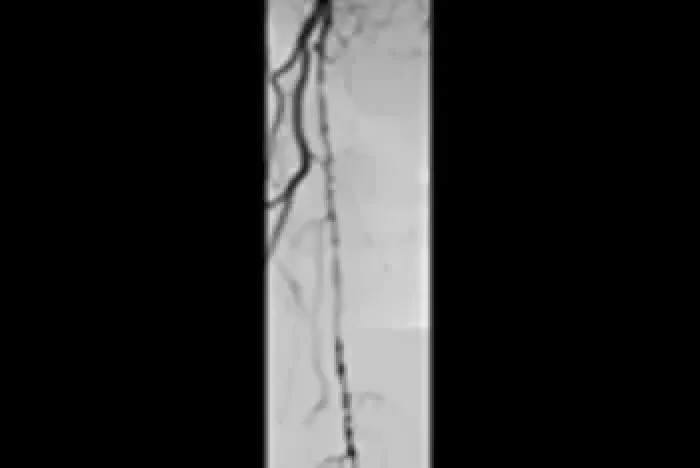
Die Kontrollbildgebung nach sechs Jahren zeigt keine erneute Okklusion trotz signifikanter Progression der Läsion der A. poplitea aufgrund einer chronischen atherosklerotischen Erkrankung.
Anfängliche Angiografien
Vor der Behandlung mit dem VIABAHN® Implantat
Proximale AFS
Distale AFS
Follow-up-Angiografien nach sechs Jahren
Erhaltung der Offenheit mit dem VIABAHN® Implantat
Proximale AFS
Distale AFS
Abbildungen mit freundlicher Genehmigung von Osamu Iida, M.D. Verwendet mit Genehmigung.
Erweiterung einer soliden Evidenzbasis
Nachweisliche Offenheit bei komplizierten AFS-Läsionen in 7 multizentrischen, prospektiven, randomisierten oder einarmigen Studien.4,8-12,14
1089
untersuchte Läsionen
71 %
chronische Totalverschlüsse (CTO)
23 cm
durchschnittliche Läsionslänge‡
80 %
durchschnittliche primäre Offenheitsrate§
Beachten Sie die Anforderungen bei der Behandlung langstreckiger AFS-Läsionen
- Die Läsionslänge ist ein Prädiktor für die erzielte Offenheit bei verschiedenen Behandlungsmethoden.
- Medikamentefreisetzende Stents
- Die Läsionslänge hat sich als unabhängiger Prädiktor für eine Restenose erwiesen.1
- In einer randomisierten Studie hat sich herausgestellt, dass der COOK® ZILVER® PTX® Drug-Eluting Peripheral Stent bei langstreckigen Läsionen > 10 cm im Vergleich zu Läsionen von 10 cm oder kürzer eine geringere Offenheit gezeigt hat.2
- Die Läsionslänge hat sich als unabhängiger Prädiktor für eine Restenose erwiesen.1
- Medikamentefreisetzender Ballonkatheter (DCB)
- Eine multivariate Analyse der globalen IN.PACT-Studie von Medtronic ergab, dass eine zunehmende Läsionslänge ein Prädiktor für ein erhöhtes Risiko einer klinisch indizierten Revaskularisierung der Zielläsion (CD TLR) ist.3
- Eine multivariate Analyse der globalen IN.PACT-Studie von Medtronic ergab, dass eine zunehmende Läsionslänge ein Prädiktor für ein erhöhtes Risiko einer klinisch indizierten Revaskularisierung der Zielläsion (CD TLR) ist.3
- Unbeschichtete Metallstents (BMS)
- Die VIASTAR-Studie hat gezeigt, dass BMS bei der Behandlung von Läsionen > 20 cm eine geringere Offenheit aufwiesen als bei der Behandlung von Läsionen, die kürzer als 20 cm waren.4
- Die VIASTAR-Studie hat gezeigt, dass BMS bei der Behandlung von Läsionen > 20 cm eine geringere Offenheit aufwiesen als bei der Behandlung von Läsionen, die kürzer als 20 cm waren.4
- Medikamentefreisetzende Stents
- Komplikationen nehmen mit der Läsionslänge zu
- Das Risiko von Dissektion bei der Verwendung von DCB nimmt mit der Läsionslänge zu.5
- Bei vielen BMS steigt die Gefahr eines Stentbruchs mit der Läsionslänge und ist mit einem Verlust der Offenheit verbunden.6,7
- Das Risiko von Dissektion bei der Verwendung von DCB nimmt mit der Läsionslänge zu.5
* Die bioaktive Heparin-Oberfläche bezieht sich bei Gore auf die firmeneigene CBAS®‑Heparin‑Oberfläche
‡ Gewichtete durchschnittliche Läsionslänge.
§ Gewichtetes Mittel der primären Offenheit nach einem Jahr.
1. Iida O, Takahara M, Soga Y, et al; ZEPHYR Investigators. 1-year results of the ZEPHYR Registry (Zilver PTX for the Femoral Artery and Proximal Popliteal Artery): predictors of restenosis. JACC: Cardiovascular Interventions 2015;8(8):1105-1112.
2. Bausback Y. 2 year results of the REAL PTX Randomized Clinical Trial comparing Zilver PTX DES vs. DCB in femoropopliteal lesions. Präsentiert bei der 7. München Vascular Conference (MAC); 7.–9. Dezember 2017; München, Deutschland.
3. Micari A, Brodmann M, Keirse K, et al; IN.PACT Global Study Investigators. Drug-coated balloon treatment of femoropopliteal lesions for patients with intermittent claudication and ischemic rest pain: 2-year results from the IN.PACT Global Study. JACC: Cardiovascular Interventions 2018;11(10):945-953.
4. Lammer J, Zeller T, Hausegger KA, et al. Heparin-bonded covered stents versus bare-metal stents for complex femoropopliteal artery lesions: the randomized VIASTAR trial (Viabahn endoprosthesis with PROPATEN bioactive surface [VIA] versus bare nitinol stent in the treatment of long lesions in superficial femoral artery occlusive disease). Journal of the American College of Cardiology 2013;62(15):1320-1327.
5. Brodmann M. Real world value of the In.Pact Admiral DCB (Medtronic) for fem-pop lesions: from the In.Pact Global Registry: what else does it tell us. Präsentiert beim 44. Annual Symposium on Vascular and Endovascular Issues, Techniques, Horizons (VEITHsymposium); 14.–18. November 2017; New York, NY.
6. Iida O, Nanto S, Uematsu M, Ikeoka K, Okamoto S, Nagata S. Influence of stent fracture on the long-term patency in the femoro-popliteal artery. JACC : Cardiovascular Interventions 2009;2(7):665-671.
7. Scheinert D, Scheinert S, Sax J, et al. Prevalence and clinical impact of stent fractures after femoropopliteal stenting. Journal of the American College of Cardiology 2005;45(2):312-315.
8. Zeller T, Peeters P, Bosiers M, et al. Heparin-bonded stent-graft for the treatment of TASC II C and D femoropopliteal lesions: the Viabahn-25 cm Trial. Journal of Endovascular Therapy 2014;21(6):765-774.
9. Reijnen MMPJ, van Walraven LA, Fritschy WM, et al. 1-year results of a multicenter, randomized controlled trial comparing heparin-bonded endoluminal to femoropopliteal bypass. Journal of Cardiovascular Interventions 2017;10(22):2320-2331.
10. Ohki T, Kichikawa K, Yokoi H, et al. Long-term results of the Japanese multicenter Viabahn trial of heparin bonded endovascular stent grafts for long and complex lesions in the superficial femoral artery. Journal of Vascular Surgery 2021;74(6):1958-1967.e2. https://www.sciencedirect.com/science/article/pii/S0741521421010119
11. Saxon RR, Chervu A, Jones PA, et al. Heparin‑bonded, expanded polytetrafluoroethylene‑lined stent graft in the treatment of femoropopliteal artery disease: 1‑year results of the VIPER (Viabahn Endoprosthesis with Heparin Bioactive Surface in the Treatment of Superficial Femoral Artery Obstructive Disease) Trial. Journal of Vascular & Interventional Radiology 2013;24(2):165‑173.
12. Iida O, Ohki T, Soga Y, et al. Twelve-month outcomes from the Japanese post-market surveillance study of the Viabahn Endoprosthesis as treatment for symptomatic peripheral arterial disease in the superficial femoral arteries. Journal of Endovascular Therapy 2022;29(6):855-865.
13. Iida O, Ohki T, Soga Y, et al. Five-Year outcomes of the GORE VIABAHN Endoprosthesis for the treatment of complex femoropopliteal lesions from a Japanese post-market surveillance study. Vascular Medicine 2024;29(4):416-423.
14. Iida O, Takahara M, Soga Y, et al; VANQUISH Investigators. One-year outcomes of heparin-bonded stent-graft therapy for real-world femoropopliteal lesions and the association of patency with the prothrombotic state based on the prospective, observational, multicenter Viabahn Stent-Graft Placement for Femoropopliteal Diseases Requiring Endovascular Therapy (VANQUISH) Study. Journal of Endovascular Therapy 2021;28(1):123-131.
15. GORE® VIABAHN® Endoprosthesis with Heparin Bioactive Surface Instructions for Use (IFU). W. L. Gore & Associates, Inc. Letzter Zugriff am 9. August 2023. https://eifu.goremedical.com
COOK und ZILVER PTX sind Markenzeichen von Cook Medical, Inc.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien
- De-novo-Läsionen oder restenotische Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Restenotische In-Stent-Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Stenose oder thrombotischer Verschluss an der venösen Anastomose synthetischer arteriovenöser Gefäßprothesen (AV-Zugänge) und im venösen Abstrom bei Shunts von Dialysezugängen, einschließlich der zentralen Venen
- Poplitealarterienaneurysmen und isolierte Viszeralarterienaneurysmen
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis)
KONTRAINDIKATIONEN:
- Nicht-elastische Läsionen, bei denen während der Prädilatation keine vollständige Aufdehnung des Angioplastie-Ballonkatheters erzielt wurde bzw. bei denen die Läsion nicht ausreichend aufgedehnt werden kann, um die Passage des Applikationssystems zu ermöglichen.
- Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht verwendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.