Ripristino del flusso nella protesi AV brachiale ascellare dopo l'insuccesso di molteplici revisioni della PTA
Uno studio dei casi che utilizzano l'endoprotesi GORE® VIABAHN® con superficie bioattiva PROPATEN*
Problematica clinica
- Soggetto maschio di 48 anni con nefropatia allo stadio terminale secondaria a nefrosclerosi ipertensiva e nefropatia diabetica
- Anamnesi del paziente pertinente:
- Diabete mellito, anemia cronica, fibrillazione atriale parossistica, coronaropatia, ipertensione, iperlipidemia, broncopneumopatia cronica ostruttiva, consumo di tabacco
- Protesi arterovenosa (AV) brachiale ascellare sinistra di 4-7 mm impiantata il 26 giugno 2018. Due revisioni, 8 aprile 2019 e 23 agosto 2019, ognuna con un pallone da PTA a forza focalizzata BD® ULTRASCORE® seguita da un catetere da 035" per PTA con pallone medicato da 9 mm x 40 mm BD® LUTONIX®
- Anamnesi del paziente pertinente:
- Si è presentato dopo l'insuccesso di due revisioni di angioplastica percutanea transluminale (PTA) dell'anastomosi venosa di una protesi arterovenosa, che impediva l'emodialisi di successo.
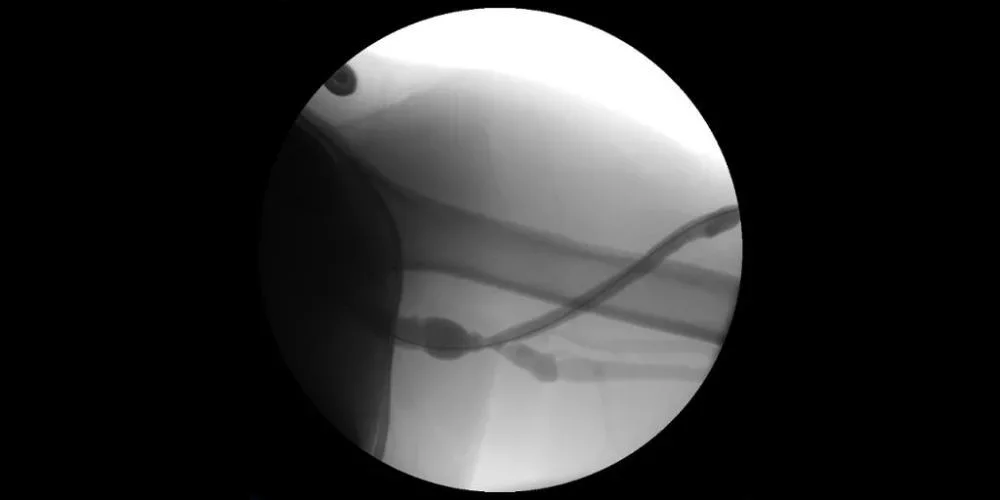
Immagine: Fistolografia con stenosi recidivante osservata all'anastomosi di deflusso venoso.
Immagini per gentile concessione di Nicolas Mouawad, M.D. Utilizzate con autorizzazione.
Procedura
- Pianificazione del trattamento definitivo con stenting di deflusso
- Avanzamento della guida da 0,035" TERUMO® RADIFOCUS® GLIDEWIRE® attraverso la lesione target (immagine a sinistra)
- Predilatazione della lesione stenotica con pallone da PTA MEDTRONIC EVERCROSS PTA BALLOON da 8 x 40 mm (immagine a sinistra)
- Posizionamento di una protesi VIABAHN® da 9 mm x 5 cm compatibile con guida di 0,035" (immagine a destra)
- Postdilatazione della lesione stenotica con un pallone da PTA MEDTRONIC EVERCROSS PTA BALLOON da 9 x 40 mm (immagine a destra)
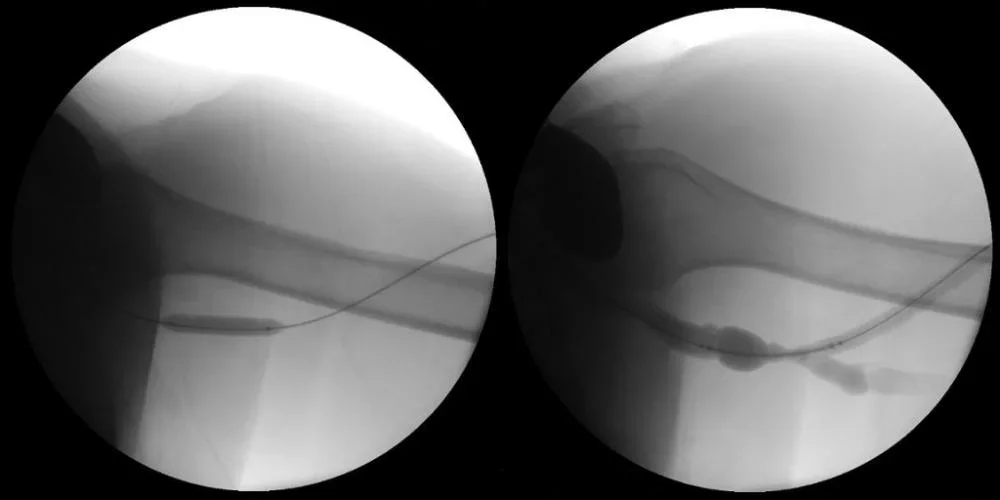
Immagine a sinistra: Preparazione della lesione con predilatazione utilizzando un pallone non compliante da 8 x 40 mm
Immagine a destra: Fistolografia di deflusso dopo PTA in preparazione del posizionamento della protesi VIABAHN®.
Immagini per gentile concessione di Nicolas Mouawad, M.D. Utilizzate con autorizzazione.
Risultato
Deflusso eccellente senza complicanze ricorrenti a otto mesi dopo l'intervento.
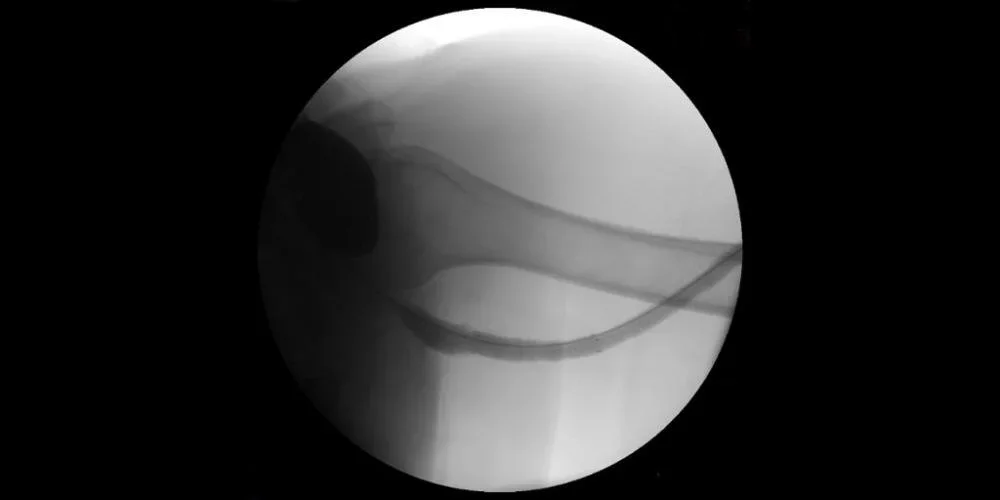
Immagine: Fistolografia dopo posizionamento dello stent con risoluzione completa della stenosi.
Immagini per gentile concessione di Nicolas Mouawad, M.D. Utilizzate con autorizzazione.
Punti chiave del caso
I risultati di questo caso si allinea ai risultati consolidati riguardanti il valore offerto dalla protesi VIABAHN® mediante la riduzione della frequenza dei reinterventi rispetto alla PTA.1
Un migliore accesso e visibilità nelle anatomie complesse sono resi possibili dal basso profilo e dai marker radiopachi sulle estremità prossimale e distale della protesi
Otto mesi dopo il posizionamento, la protesi VIABAHN® ha superato i risultati ottenuti con i precedenti trattamenti con PTA; la pervietà primaria dell'endoprotesi è mantenuta, senza reinterventi sul circuito dopo il posizionamento della protesi VIABAHN®.

Studi di casi pertinenti
* Come inteso da GORE, superficie bioattiva PROPATEN si riferisce alla superficie eparinata CBAS® di proprietà di Gore.
- Mohr BA, Sheen AL, Roy-Chaudhury P, Schultz SR, Aruny JE; REVISE Investigators. Clinical and economic benefits of stent grafts in dysfunctional and thrombosed hemodialysis access graft circuits in the REVISE Randomized Trial. Journal of Vascular & Interventional Radiology 2019;30(2):203-211.e4. https://www.jvir.org/article/S1051-0443(18)31772-X/fulltext
BD, LUTONIX e ULTRASCORE sono marchi commerciali di Becton, Dickinson and Company.
MEDTRONIC e EVERCROSS sono marchi commerciali di Medtronic, Inc.
TERUMO e RADIFOCUS sono marchi commerciali di Terumo Medical Corporation.
I risultati e le osservazioni segnalati sono basati sull'esperienza di casi individuali e sui pazienti trattati. Le fasi descritte in questo articolo potrebbero non essere complete e non sono destinate a sostituire né le Istruzioni per l'uso, né l'istruzione, la formazione e il giudizio professionale degli healthcare provider. Gli healthcare provider rimangono responsabili delle decisioni prese riguardanti la cura dei pazienti e l'uso delle tecnologie mediche.

Per una descrizione completa di tutte le indicazioni, le avvertenze, le precauzioni e le controindicazioni vigenti nei mercati in cui il prodotto è disponibile, consultare le Istruzioni per l'uso sul sito eifu.goremedical.com. RXOnly
INDICAZIONI PER L'USO IN EUROPA: L'endoprotesi GORE® VIABAHN® con superficie bioattiva PROPATEN è indicata per il trattamento di:
- lesioni de novo o ristenotiche delle arterie iliache
- lesioni de novo o ristenotiche dell'arteria femorale superficiale e dell'arteria poplitea prossimale
- lesioni ristenotiche intrastent dell'arteria femorale superficiale e dell'arteria poplitea prossimale
- stenosi o occlusione trombotica nell'anastomosi venosa della protesi sintetica per l'accesso arterovenoso (AV) e nel deflusso venoso dei circuiti di accesso per dialisi, comprese le vene centrali
- aneurismi dell'arteria poplitea e aneurismi isolati delle arterie viscerali
- lesioni vasali traumatiche o iatrogene delle arterie che sono posizionate nella cavità toracica, addominale o pelvica (con l'eccezione di aorta, coronarie, tronco arterioso brachiocefalico, carotidi, arterie vertebrali e polmonari)
CONTROINDICAZIONI:
- Nelle lesioni non complianti, laddove un pallone per angioplastica non abbia raggiunto l'espansione completa durante la predilatazione, oppure qualora fosse impossibile dilatare le lesioni in misura sufficiente per consentire il passaggio del sistema di rilascio.
- L'endoprotesi GORE® VIABAHN® con superficie bioattiva PROPATEN non deve essere utilizzata in pazienti con nota ipersensibilità all'eparina, compresi i pazienti che hanno manifestato un precedente evento di trombocitopenia indotta da eparina (HIT) di tipo II.

