Wiederherstellung des Blutflusses einer brachioaxillären AV-Prothese nach mehreren fehlgeschlagenen PTA-Revisionen
Eine Fallstudie mit der GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche*
Herausforderung
- 48-jähriger Mann mit Nierenerkrankung im Endstadium infolge hypertensiver Nephrosklerose und diabetischer Nephropathie
- Relevante Patientenanamnese:
- Diabetes mellitus, chronische Anämie, paroxysmales Vorhofflimmern, koronare Herzkrankheit, Bluthochdruck, Hyperlipidämie, COPD, Tabakkonsum
- Linke brachioaxilläre arteriovenöse Prothese (AV-Prothese) 4–7 mm, implantiert am 26. Juni 2018. Zwei Revisionen am 8. April 2019 und am 23. August 2019, beide mit einem BD® ULTRASCORE® PTA-Ballon mit gebündelter Kraft, gefolgt von einem 9 mm x 40 mm BD® LUTONIX® 035 Medikamentenbeschichteten PTA-Ballonkatheter
- Relevante Patientenanamnese:
- Vorstellung nach zwei fehlgeschlagenen Revisionen mit perkutaner transluminaler Angioplastie (PTA) der venösen Anastomose einer arteriovenösen Prothese, wodurch eine erfolgreiche Hämodialyse verhindert wurde.
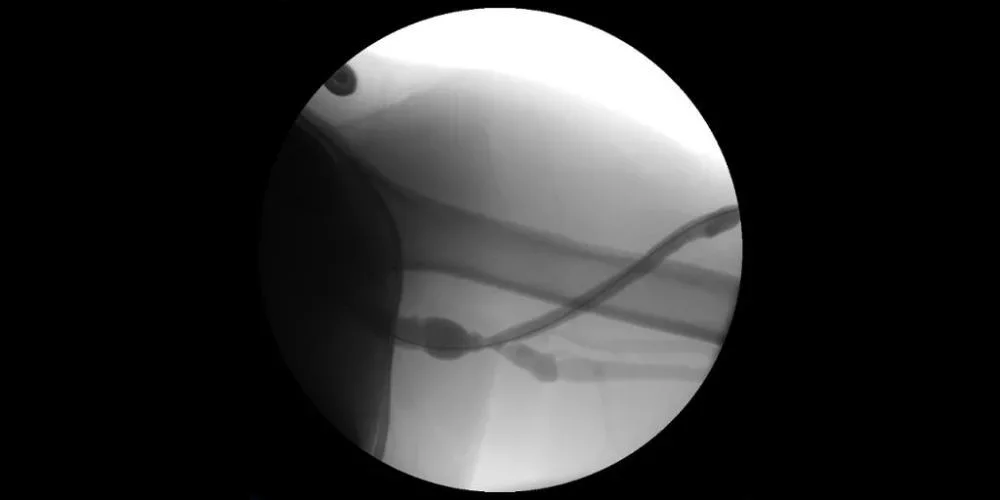
Abbildung: Fistulografie mit rezidivierender Stenose an venöser Abstromanastomose festgestellt.
Abbildungen mit freundlicher Genehmigung von Nicolas Mouawad, M.D. Verwendet mit Genehmigung.
Verfahren
- Geplante definitive Behandlung mit Stentimplantation im Abstrom
- Vorschieben des TERUMO® RADIFOCUS® GLIDEWIRE® ADVANTAGE 0,035-Zoll-Führungsdrahts durch die Zielläsion (Abbildung links)
- Prädilatation der stenotischen Läsion mit einem 8 x 40 mm MEDTRONIC EVERCROSS PTA BALLON-Katheter (Abbildung links)
- Platzierung eines VIABAHN® Implantats, kompatibel mit dem 9 mm x 5 cm 0,035-Zoll-Führungsdraht (Abbildung rechts)
- Postdilatation mit einem 9 x 40 mm MEDTRONIC EVERCROSS PTA BALLON-Katheter (Abbildung rechts)
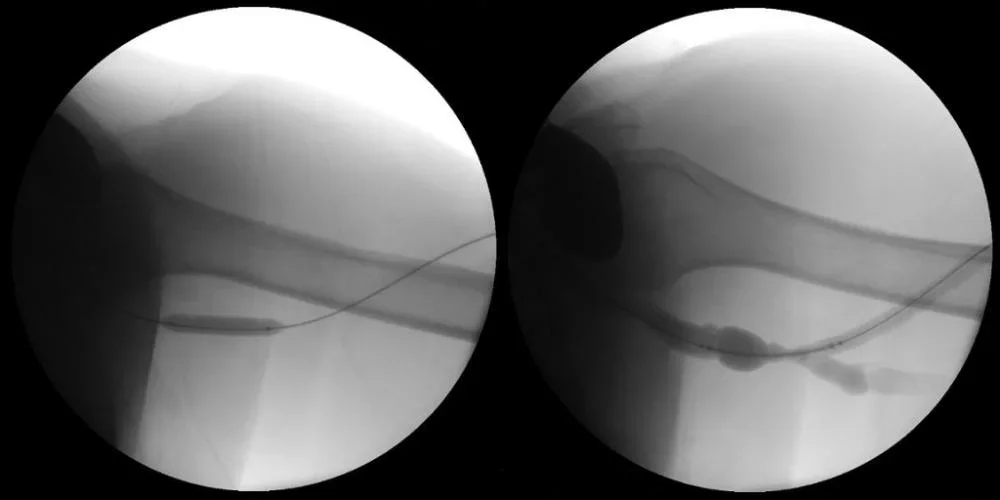
Abbildung links: Präparation der Läsion mit Prädilatation mit einem 8 x 40 mm nicht-elastischen Ballon.
Abbildung rechts: Abstrom-Fistulografie nach PTA zur Vorbereitung auf die Freisetzung des VIABAHN® Implantats.
Abbildungen mit freundlicher Genehmigung von Nicolas Mouawad, M.D. Verwendet mit Genehmigung.
Ergebnis
Hervorragender Abstrom ohne rezidivierende Komplikationen 8 Monate nach der Intervention.
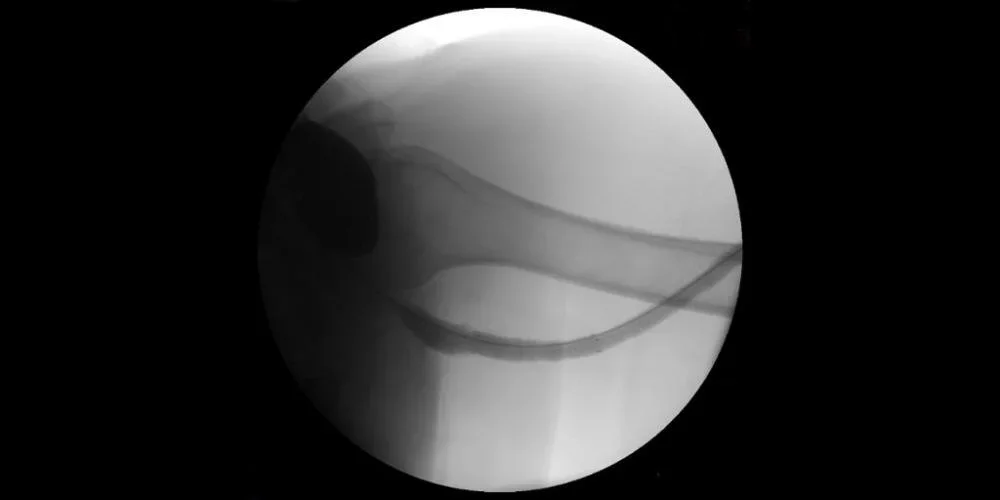
Abbildung: Fistulografie nach Stentfreisetzung mit vollständiger Behebung der Stenose.
Abbildungen mit freundlicher Genehmigung von Nicolas Mouawad, M.D. Verwendet mit Genehmigung.
Fallpunkte
Das Ergebnis dieses Falles stimmt mit den gesicherten Erkenntnissen überein, dass das VIABAHN® Implantat im Vergleich zur PTA einen Mehrwert durch eine geringere Häufigkeit von wiederholten Interventionen bietet.1
Ein besserer Zugang und eine erhöhte Sichtbarkeit bei schwierigen anatomischen Verhältnissen werden durch ein kleines Profil und Röntgenmarkierungen an den proximalen und distalen Enden des Implantats erreicht.
Nach 8 Monaten nach der Platzierung hat das VIABAHN® Implantat die mit vorherigen PTA-Behandlungen erzielten Ergebnisse übertroffen. Die primäre Offenheitsrate der Endoprothese bleibt erhalten, ohne dass nach der Platzierung des VIABAHN® Implantats Reinterventionen des Circuits erforderlich sind.

Relevante Fallstudien
* Bioaktive PROPATEN Oberfläche bezieht sich bei Gore auf die firmeneigene CBAS®‑Heparin‑Oberfläche.
- Mohr BA, Sheen AL, Roy-Chaudhury P, Schultz SR, Aruny JE; REVISE Investigators. Clinical and economic benefits of stent grafts in dysfunctional and thrombosed hemodialysis access graft circuits in the REVISE Randomized Trial. Journal of Vascular & Interventional Radiology 2019;30(2):203-211.e4. https://www.jvir.org/article/S1051-0443(18)31772-X/fulltext
BD, LUTONIX und ULTRASCORE sind Markenzeichen von Becton, Dickinson and Company.
MEDTRONIC und EVERCROSS sind Markenzeichen von Medtronic, Inc.
TERUMO und RADIFOCUS sind Markenzeichen von Terumo Medical Corporation.
Die Ergebnisse und Beobachtungen, über die berichtet wird, beruhen auf den Erfahrungen mit einzelnen Fällen sowie mit den behandelten Patienten. Die hier beschriebenen Schritte sind möglicherweise nicht vollständig und sind nicht als Ersatz für die Gebrauchsanweisung oder die Ausbildung, Schulung und das professionelle Urteil von Ärzten/Ärztinnen vorgesehen. Ärzte/Ärztinnen tragen allein die Verantwortung für Entscheidungen zur Behandlung der Patienten und die Verwendung medizinischer Technologien.

Eine vollständige Beschreibung aller geltenden Indikationen, Warnhinweise, Vorsichtsmaßnahmen und Kontraindikationen für die Länder, in denen dieses Produkt angeboten wird, finden Sie in der Gebrauchsanweisung unter eifu.goremedical.com. RXOnly
INDIKATIONEN IN EUROPA: Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche ist zur Behandlung in den folgenden Fällen indiziert:
- De-novo-Läsionen oder restenotische Läsionen der Iliakalarterien
- De-novo-Läsionen oder restenotische Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Restenotische In-Stent-Läsionen der A. femoralis superficialis und der proximalen A. poplitea
- Stenose oder thrombotischer Verschluss an der venösen Anastomose synthetischer arteriovenöser Gefäßprothesen (AV-Zugänge) und im venösen Abstrom bei Shunts von Dialysezugängen, einschließlich der zentralen Venen
- Poplitealarterienaneurysmen und isolierte Viszeralarterienaneurysmen
- Traumatische oder iatrogene Gefäßschädigungen von Arterien, die sich in der Brusthöhle, im Bauchraum oder im Becken befinden (außer Aorta, Koronararterien, Truncus brachiocephalicus, Karotiden, A. vertebralis und A. pulmonalis)
KONTRAINDIKATIONEN:
- Nicht-elastische Läsionen, bei denen während der Prädilatation keine vollständige Aufdehnung des Angioplastie-Ballonkatheters erzielt wurde bzw. bei denen die Läsion nicht ausreichend aufgedehnt werden kann, um die Passage des Applikationssystems zu ermöglichen.
- Die GORE® VIABAHN® Endoprothese mit bioaktiver PROPATEN Oberfläche darf bei Patienten mit bekannter Überempfindlichkeit gegen Heparin nicht verwendet werden. Dies gilt insbesondere auch für die Patienten, bei denen in der Vergangenheit eine heparininduzierte Thrombozytopenie (HIT) vom Typ II aufgetreten ist.

